Morfologie bakterií
| Stránky: | Moodle Veterinární univerzita Brno |
| Kurz: | Mikrobiologie potravin a mikrobiologické laboratorní metody 1 |
| Kniha: | Morfologie bakterií |
| Vytiskl(a): | Nepřihlášený host |
| Datum: | pondělí, 2. června 2025, 14.28 |
Popis
Kapitola popisuje morfologii bakterií.
Úvod
Bakteriální buňka je výrazně menší než buňka eukaryot, odpovídá svou velikostí zhruba velikosti mitochondrií. Bakterie jsou pozorovatelné pouze v optickém či elektronovém mikroskopu. Při popisu bakteriálních buněk zohledňujeme jejich velikost, tvar a uspořádání. Z hlediska jejich zařazení je důležitým znakem i barvitelnost Gramovým barvením.
Morfologické znaky bakterií dělíme podle použitých metod na makroskopické (pozorování mikroorganismů narostlých na kultivačních médiích pouhým okem) a mikroskopické viditelné při pozorování ve světelném nebo elektronovém mikroskopu.
Makroskopické pozorování kolonií mikrobů na kultivačních agarových půdách nám přináší mnohé cenné informace o povaze mikroorganismů i čistotě kultury. Pečlivým pozorováním kolonií můžeme podle jejich vzhledu, pigmentace, konzistence a interakce s kultivačním médiem orientačně identifikovat rod, v některých případech i druh bakterií.
Mikroskopickými metodami zjišťujeme tvar, velikost, uspořádání a barvitelnost bakterií v preparátu. Dále lze mikroskopickým pozorováním posoudit přítomnost některých buněčných struktur či pohyblivost buněk. Podle těchto morfologických znaků můžeme orientačně určit čeleď, rod nebo skupinu, do které barvené bakteriální kultury náleží. Mikroskopickou metodu lze použít pro kvantitativní nebo kvalitativní stanovení bakterií.
Základní informace
Tvar bakterií je kulovitý (koky, řecky coccos = jádro) nebo protáhlý. Protáhlým formám říkáme tyčinky (latinsky bacillus, řecky bacterium ze slova bactérion = hůlka). Tyčinky mohou být rovné, prohnuté nebo vytváří tzv. vlákna. Jen výjimečně je bakterie nesymetrického tvaru.
Bakteriální buňky se mohou vyskytovat jednotlivě nebo jsou uspořádány do charakteristických útvarů – dvojice, řetízky, shluky, palisády, atd.
Tvar bakterií je značně proměnlivý, závisí na řadě vnějších vlivů – růstová fáze, věk kultury, složení živného média (preparát nepřipravujeme ze selektivních médiích). Ovlivňují jej také antibiotika či chemoterapeutika.
U některých bakterií se setkáváme s tzv. pleomorfismem – rozmanitostí tvarů. Rozumí se tím existence odlišných morfologických forem u téhož druhu či kmene mikroorganismu. V jednom preparátu můžeme potom současně pozorovat formy kokobacilární, tyčinky různé délky, příp. i vláknité formy. Pleomorfismus se vyskytuje např. u bakterií mléčného kvašení či mykoplazmat.
Tvar a uspořádání koků

Koky jsou nejčastěji kulaté nebo ovoidní (enterokoky), mohou však být i různě oploštělé (tvar kávového zrna) nebo protáhlé a zašpičatělé – lancetovité (např. Streptococcus pneumoniae). Průměrná velikost koků je asi 1 µm.
Tvar a uspořádání tyčinek
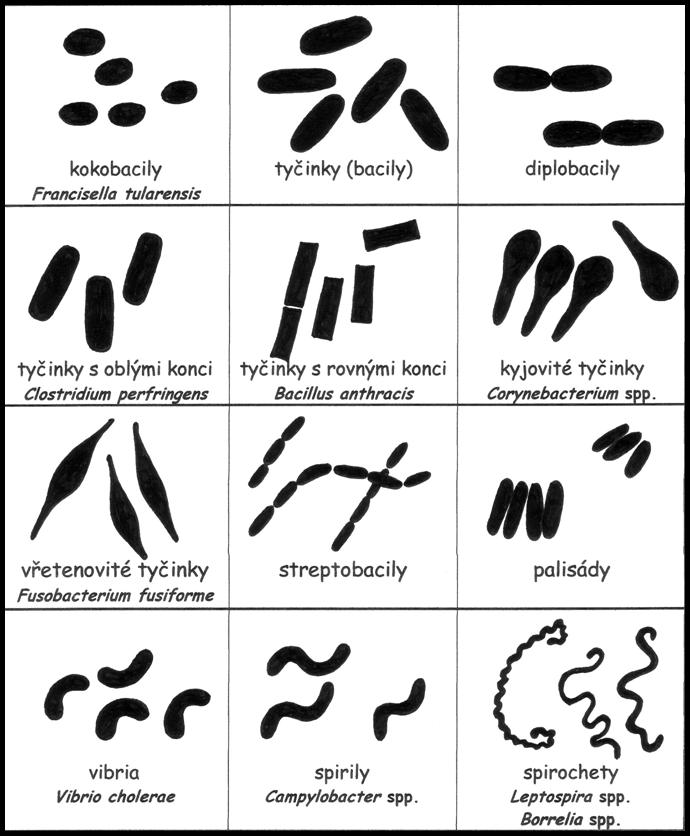
Při popisu tyčinek je důležitý nejen tvar, ale i relativní velikost (tyčinky štíhlé či robustní), ukončení buněk (tyčinky se zaoblenými či rovnými konci) a různá rozšíření (kyjovité tyčinky, vřetenovité tyčinky), které jsou druhově specifické.
Vláknité a bizarní bakterie

dělením buněk ve vláknech (rozrůstáním vláken), tvorbou jednobuněčných spor vznikajících podél vláken nebo na jejich konci či rozpadem vláken v jednotlivé buňky.
Růst v tekutém médiu
Při růstu mikroorganismů v tekutém médiu si všímáme následujících znaků:
- vzhled povrchu - vláknitý či sametový kožovitý povlak plísní, kvasinky rostou ve formě křísu (bílé zvrásnělé blanky), atd.;
- tvorba zákalu - zákal může být difuzní, vločkovitý nebo se tvoří sedlina na dně kultivační nádoby;
- tvorba sedimentu - sediment může být zrnitý, vločkovitý, hlenovitý, roztřepatelný, neroztřepatelný; některé kvasinky tvoří po delší době kultivace kašovitý sediment (tzv. mázdra) nebo kašovitý prstenec podél stěn zkumavky či baňky;
- vůně či zápach - fekální, nasládlý, amoniakální, kvasničný, atd
Povrchový růst mikroorganismů v tekutém médiu lze ovlivnit přídavkem neionogenních povrchově aktivních látek (např. Tweenu 80), které zlepší smáčitelnost buněk. Tuto skutečnost je nutno brát při hodnocení růstu na zřetel.
Vzhled kolonií na pevné půdě
Při posuzování vzhledu kolonií pozorujeme následující ukazatele:
- profil, tvar a okraje kolonie;
- velikost – kolonie mohou mít různou velikost od drobných (např. enterokoky) až po tzv. obrovské (např. kolonie Bacillus cereus, kvasinek a plísní);
- barva – sledujeme barvu kolonií, které mohou být např. bílé, žluté, krémové, oranžové, černé, průhledné; je třeba odlišit barvu kolonie (ta je obvykle dána chemickými změnami složek živného média) od produkce pigmentu (přirozená vlastnost některých bakterií, např. S. aureus), kterou můžeme pozorovat pouze při růstu mikroorganismů na základních a obohacených médiích, pigmentace se zvýrazní nabráním bakteriální kultury kličkou;
- konzistence kolonií – hladká, slizovitá, moučnatá, kožovitá, atd.;
- interakce s kultivačním médiem – hemolýza, biochemické reakce v okolí kolonií (např. precipitace, projasnění), zbarvení okolí kolonií, atd.;
- rychlost růstu – některé mikroorganismy rostou pomalu, až několik týdnů (mykobakterie), jiné naopak rychle do 18 hodin (např. většina střevních bakterií).
Obecně platí, že vzhled kolonie je také výrazně ovlivněn stářím kultury a kultivačními podmínkami. Mladší kolonie bývají hladší s rovnějšími okraji a teprve později se může objevit rýhování, zdrsnění, propadlý střed a různé nerovnosti. Také složení živného média silně ovlivňuje vzhled kolonií, současně může docházet k již zmíněným interakcím mezi kolonií a živnou půdou. Proto je při makroskopickém pozorování kolonií vždy nezbytně nutné uvést podmínky kultivace (teplota a především doba kultivace) a použité kultivační médium.
Vzhled kolonií na pevné půdě
Příklady základních morfologických znaků kolonií – profil, tvar a okraj.
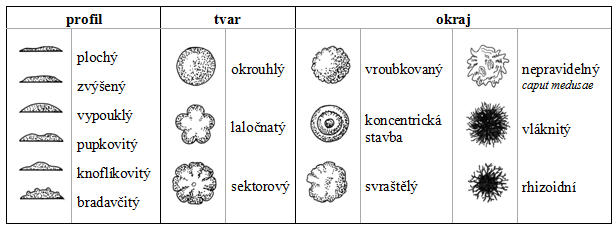
(zdroj: HAVLOVÁ, J., JIČÍNSKÁ, E., HRABOVÁ, H. Mikrobiologické metody v kontrole jakosti mléka a mlékárenských výrobků. 1. vyd. Praha, ČR: ÚZPI. 1993. 243 p. - upraveno)
Kvantitativní mikroskopické vyšetření
Metoda je používána pro rychlé orientační zjištění počtu mikroorganismů v tekutých, rozpuštěných nebo, v případě pevných matric, homogenizovaných vzorcích obsahujících větší množství mikroorganismů. Tekuté vzorky se vyšetřují přímo, ostatní se homogenizují v přesně odměřeném množství sterilního fyziologického roztoku v poměru 1:9 nebo 1:99 (tj. 1 + 9 nebo 1 + 99) tak, aby se počet mikroorganismů v zorném poli pohyboval od 10 do 100.
Přesný postup provedení - viz skripta Mikrobiologie potravin – praktická cvičení I. Obecná mikrobiologie. Revidované vydání, kapitola 6.2.1. Praktické využití při kvantitativním hodnocení čistých mlékařských kultur - viz skripta Mikrobiologie potravin – praktická cvičení II. Metody stanovení mikroorganismů v potravinách, kapitola 5.2.
Základní kroky:
- zhotovení preparátu - na šablonu s vyznačenými čtverci o straně 1 cm se položí čisté odmaštěné podložní sklíčko, mikropipetou se na každý čtverec nanese 0,01 ml vzorku nebo jeho ředění a rovnoměrně se rozetře kličkou na celou plochu čtverce. Po úplném zaschnutí se preparáty fixují trojnásobným protažením sklíčka v plameni. Lze využít také počítací komůrku (např. Bürkerova či Thomova komůrka).
- barvení preparátu - preparáty se barví 1-3 minuty roztokem barviva (např. roztokem malachitové zeleně nebo Löfflerovy methylenové modři). Poté se barvivo opatrně opláchuje pod tekoucí vodou tak, aby proud vody nedopadal přímo na preparát. Zbytky vody se z okrajů sklíčka odstraní filtračním papírem a preparát se nechá zaschnout.
- odečítání výsledků - preparát se prohlíží v mikroskopu imerzním objektivem za použití imerzního oleje, počítá se počet bakterií v předepsaném počtu zorných polí. Mikrobiální shluky, řetízky a dvojice se pokládají za jednu jednotku. Prohlížíme systematicky na různých místech (meandrovitý pohyb).
- výpočet konstanty mikroskopu - na základě zjištěného průměru zorného pole vypočítáme konstantu mikroskopu.
- výpočet počtu mikroorganismů - z počtu vyšetřovaných polí a počtu mikroorganismů v nich se vypočte průměrný počet mikrobů v zorném poli. Ten se přepočte na 1 ml vzorku tak, že se násobí faktorem konstantním pro určitou optiku (= konstanta mikroskopu) a stupněm ředění vzorku. Výsledek se vždy zaokrouhlí na dvě číslice různé od nuly (jednotky a desetiny).
Kvalitativní mikroskopické vyšetření
Mikroorganismy můžeme pozorovat:
a) v nativním preparátu (hodnocení morfologie kvasinek a plísní, průkaz střevních parazitů, atd.),
b) ve vlhké komůrce a ve visuté kapce (dlouhodobé pozorování mikroorganismů, hodnocení vývoje, růstu či pohybu),
c) ve fixovaném barevném preparátu (hodnocení morfologie bakterií, zjištění přítomnosti spor, pouzder a dalších buněčných struktur).
Nativní preparát ukazuje skutečný tvar buněk neovlivněný fixací a barvením, můžeme v něm pozorovat i pohyb bakterií. Odmaštěné podložní sklíčko protáhneme v plameni a umístíme na tmavou podložku. Do kapky sterilního fyziologického roztoku sterilní kličkou dobře rozmícháme malé množství mikrobiální kultury. K okraji kapky přiložíme krycí sklíčko a lehce je přitiskneme na suspenzi tak, abychom odstranili vzduchové bubliny. Přebytečnou tekutinu odsajeme filtračním papírem. Pro pozorování nativního preparátu je nejvhodnější mikroskopie s fázovým kontrastem.
Při přípravě fixovaného preparátu vetřeme kličkou do kapky sterilního fyziologického roztoku na odmaštěném podložním sklíčku malé množství bakteriální kultury a dokonale ji zhomogenizujeme. Kapku rozetřeme v tenké vrstvě po povrchu sklíčka a necháme zaschnout při laboratorní teplotě na bezprašném místě. Po úplném zaschnutí se preparáty fixují trojnásobným protažením podložního sklíčka v plameni nátěrem buněk vzhůru (dojde k denaturaci proteinů a devitalizaci mikroorganismů). Nevýhodou fixace za horka je narušení vnitřní struktury buněk. Proto se při přípravě preparátu k hodnocení vnitřních buněčných struktur doporučuje použití chemické fixace (např. ethanol, formaldehyd, kyselina octová).
Kvalitativní mikroskopické vyšetření
Rozlišujeme dva hlavní typy barvení preparátu – jednoduché (přehledné) barvení a barvení diferenciální.
Při jednoduchém barvení se používají základní barviva jako methylenová modř, krystalová violeť, safranin či karbolfuchsin, barvení slouží k hodnocení základního tvaru a uspořádání mikrobiálních buněk.
Při diferenciálním barvení se současně používají nejméně dvě barviva, barvení umožňuje odlišení různých skupin mikroorganismů (např. Gramovo barvení, barvení podle Ziehl-Neelsena) či zviditelnění struktur mikrobiální buňky (endospory, bičíky, atd.). Hotový preparát se prohlíží imerzním objektivem za použití imerzního oleje.
Barvení podle Grama a KOH test
Základním diferenciálním barvením používaným v mikrobiologii k hodnocení morfologie buněk mikroorganismů je barvení podle Grama. Umožňuje rozlišení bakterií na grampozitivní, gramnegativní a gramlabilní. Přesný postup provedení a vyhodnocení je uveden v následujícím studijním materiálu.
KOH test
U některých mikroorganismů se často vlivem prostředí barví buňky Gramovým barvením velmi slabě, nedokonale nebo vůbec a nelze zhodnotit, zda je mikroorganismus grampozitivní či gramnegativní. V těchto případech lze provést velmi jednoduchou a rychlou zkoušku s KOH.
Na podložní sklíčko naneseme bakteriologickou kličkou testovanou kulturu z agarového živného média a přikápneme jednu kapku 3% roztoku KOH. Kličkou obě složky rychle promícháme a pokusíme se oddálením kličky na vzdálenost 1 – 2 cm od podložního skla vytáhnout z kapky vlákno. Jedná-li se o gramnegativní mikroorganismus, dojde k vytažení vlákna. V případě grampozitivních mikroorganismů se vlákno nevytvoří. Test se musí odečítat do 30 sekund po smíchání KOH s mikrobiální kulturou, později může dojít k falešně pozitivnímu výsledku.


a) gramnegativní MO b) grampozitivní MO
(zdroj: http://jjkaos.tistory.com/category/Microbiology)
Další barvicí postupy
Barvení spor
Při hodnocení morfologie sporotvorných mikroorganismů (rody Bacillus a Clostridium) se často hodnotí i tvar a uložení jejich endospor. Díky špatně propustnému obalu se spory velmi těžko barví, musí se používat koncentrovaná barviva či různá mořidla a vyšší teplota barvení. K odbarvování se používají kyseliny či alkohol. Jednou z možností je barvení podle Schaeffer-Fultona či využití mikroskopie s fázovým kontrastem.
Barvení pouzder
Některé mikroorganismy vytváří okolo své buňky silně hydratovanou, obvykle polysacharidovou vrstvu – pouzdro. Pouzdro je rozpustné ve vodě a může být uvolněno při oplachování, současně pouzdra nepřijímají běžná barviva. Při jejich barvení je nezbytné preparát nejdříve mořit (např. síranem železnatým) nebo použít negativní barvení tuší.
Acidorezistentní barvení podle Ziehl-Neelsena
Toto barvení se používá u mikroorganismů, jejichž buněčná stěna obsahuje vysoký podíl mastných kyselin nebo vosků (např. Mycobacterium spp.). Je díky tomu hydrofobní a vytváří relativně nepropustnou bariéru pro vodou rozpustná barviva či další látky. Tyto mikroorganismy jsou velmi odolné proti účinku kyselin a zásad. Vlastní barvení se provádí za horka (opakovaný záhřev do výstupu par) koncentrovaným karbolfuchsinem, odbarvení se provádí kyselinou sírovou nebo kyselým alkoholem.
Negativní barvení pro mikrometrii
Pokud potřebujeme měřit velikost mikroorganismů, nelze preparát fixovat ani barvit, protože tyto zásahy mohou měnit velikost buněk. V tomto případě se tedy využívá negativního barvení, kdy se obarví pozadí preparátu (plochy mezi jednotlivými buňkami). Vlastní buňky zůstávají na tmavém pozadí bezbarvé. K negativnímu barvení se používá zředěná tuš nebo kyselá barviva (kongo červeň, nigrosin).
Mikrometrie - měření velikosti mikroorganismů
Ve světelném mikroskopu lze také měřit velikost buněk, příp. i jejich struktur. K měření velikosti mikroorganismů je zapotřebí okulárový a objektivový mikrometr (měřítko). Okulárový mikrometr je skleněná destička s vyrytou stupnicí, která se vkládá mezi čočky okuláru. Objektivový mikrometr je podložní sklíčko s mikrometrickým měřítkem o známém rozměru (známe délku stupnice, počet dílků a velikost 1 dílku).
Před vlastním měřením se nejprve okulárový mikrometr pomocí objektivového kalibruje a pro daný okulár a objektiv se vypočítá tzv. mikrometrický koeficient, který udává velikost 1 dílku okulárového mikrometru. Při stanovení velikosti buněk v preparátu měříme jejich rozměr okulárovým mikrometrem a zjištěný počet dílků násobíme mikrometrickým koeficientem.