Příručky - krmiva psů a koček
| Stránky: | Moodle Veterinární univerzita Brno |
| Kurz: | Veterinární dietetika |
| Kniha: | Příručky - krmiva psů a koček |
| Vytiskl(a): | Nepřihlášený host |
| Datum: | pátek, 4. července 2025, 04.12 |
Popis
Příručky - krmiva psů a koček
Obsah
- 1. Obsah
- 2. Obecné zásady při výběru průmyslového krmiva
- 3. Specifita nutričních požadavků kriticky ohroženého pacienta
- 4. Specifita nutričních požadavků psů a koček trpících nádorovými onemocněními
- 5. Specifita nutričních požadavků psů a koček trpících kardiovaskulárním onemocněním
- 6. Specifita nutričních požadavků psů a koček trpících onemocněním vylučovacího systému
- 7. Specifita veterinárních diet pro psy, kočky trpících endokrinními poruchami
- 8. Specifita nutričních požadavků psů a koček trpících GIT poruchami
- 9. Specifita nutričních požadavků psů a koček trpících onemocněním pohybového aparátu
- 10. Nežádoucí reakce na krmivo
1. Obsah
Obecné zásady výběru průmyslového krmiva:
Specifita nutričních požadavků kriticky ohroženého pacienta
Specifita nutričních požadavků psů a koček trpících nádorovými onemocněními
Specifita nutričních požadavků psů a koček trpících kardiovaskulárním onemocněním
Specifita nutričních požadavků psů a koček trpících onemocněním vylučovacího systému
Specifita veterinárních diet pro psy, kočky trpících endokrinními poruchami
Specifita nutričních požadavků psů a koček trpících GIT poruchami
Specifita nutričních požadavků psů a koček trpících onemocněním pohybového aparátu
Nežádoucí reakce na krmivo
2. Obecné zásady při výběru průmyslového krmiva
Obecné zásady výběru průmyslového krmiva:
FEDIAF - Nutritional Guidelines
Hodnocení:
- komponentního složení
- deklarovaného obsahu živin
Komponentního složení
Zdroje proteinů
- druhově specifická masová moučka (meal), maso (meat, čerstvé maso – přibližně 70 % vody)
(kuřecí, krutí x drůbeží
lososová x rybí
vepřová x živočišná)
- odhad kvality živočišné moučky - dle obsahu popela (podíl kostí) - kvalitní moučky 8 -12% popela (ash)
- vejce (celá vejce)
- NE vedlejší produky živočišné či rostlinné výroby
(vedlejší živ. produkty = kůže, peří, vnitřnosti, pařáty,…)
(vedlejší rost. produkty = sója, pšeničný gluten, kukuřičný gluten,…)
Běžný obsah proteinů a poměr protein:popeloviny v častých komponentách krmiv
|
Komponenta |
Protein (%) |
Protein:popel |
|
Drůbeží moučka – vedlejší živ. produkty |
65-70 |
6:1 |
|
Masokostní moučka |
50-55 |
2:1 |
|
Kuřecí moučka |
63-67 |
4:1 |
|
Jehněčí moučka |
48-55 |
2,5:1 |
|
Rybí moučka |
60-65 |
3:1 |
|
Sójový ex. šrot |
46-50 |
10:1 |
|
Kukuřičný lepek |
60-64 |
25:1 |
|
Vaječné produkty |
43-48 |
8:1 |
Zdroje tuků
- druhově specifické
(lososový olej x rybí olej
vepřové sádlo x živočišný tuk)
Konzervanty
- pouze přírodní konzervanty (vitamín C a E, ...)
X chemické konzervanty (BHA, BHT, ....)
Zdroje sacharidů
- škrob (brambory, batáty, maniok, obiloviny – celá zrna, …)
- vláknina (rozpustná x nerozpustná)
Deklarovaný obsah živin
- hrubý protein
- hrubý tuk
- hrubá vláknina (2-5 % v suchých krmivech, redukce hmotsnoti/DM až 10 %)
- hrubý popel (do 8% v suchých krmivech)
- vlhkost (do 10 %)
- metabolizovatelná energie
- minerální látky (Ca v suchém krmivu u velkých plemen psů – 0,8-1,2 %)
- vitamíny

Výběr konzervovaného krmive dle Whole Dog Journal
Příklady aditiv v krmivech psů/koček
Antioxidanty
- přírodní (tokoferoly, kyselina rozmarýnová – rosemaric acid,…kyselina L-askorbová)
- syntetické (ethoxyquin, BHA – butylhydroxyanisol, BHT – butylhydroxytoluen, propyl gallát,…)
Konzervanty
- propionát vápenatý (calcium propionate)
- kyselina citronová (citric acid)
- kyselina fumarová (fumaric acid)
- kyselina propionová (propionic acid)
- kyselina sorbová (sorbic acid)
- dusitan sodny (sodium nitrite)
- propionát sodný (sodium propionate)
- sorbát draselný (potassium sorbate)
- kyselina fosforečná (phosphoric acid)
- kyselina chlorovodíková (hydrochloric acid)
Zvlhčující látky (humektanty)
- třtinová melasa (cane molasses)
- propylenglykol
- sorbitol
- (sacharóza/dextróza)
Barviva
- oxid titaničitý (titanium dioxide)
- dusitan sodný (sodium nitrite)
- oxid železitý (iron oxide)
- tartrazin (tartrazine)
- briliantová modř (brilliant blue)
Příchutě/ Zchutňovadla
- extrakty masa, jater (meat extracts, liver meal)
- sušený česnek (onion powder)
- glutamát sodný (monosodium glutamate)
- kyselina fosforečná (phosphoric acid)
- sachoróza, dextróza, třtinová melasa
Emulzifikatory/Zahušťovadla/Stabilizátory
- lecitin (sójový, slunečnicový – soybean, sunflower lecithin)
- mono a di glyceridy (mono- and diglycerides)
- gumy (karagenan – carrageenan, guarová guma – guar gum, xantanová guma – xanthan gum, algináty – alginates)
- modifikované škroby (modified starch)
Vyhláška č. 356/2008 Sb., kterou se provádí zákon č. 91/1996 Sb., o krmivech, ve znění pozdějších předpisů Příl.11 - Doplňkové látky (aditiva)
3. Specifita nutričních požadavků kriticky ohroženého pacienta
Výživa kriticky ohroženého pacienta
- zvíře v kritickém stavu = narušení mtb adaptace, která brání dramatickému úbytku hmotnosti a chrání fce tkání a orgánů
- zvíře v kritickém stavu = stresové hladovění (hypermetabolický stav)
- ztráta tělesné hmotnosti, svalové hmoty
- pokles imunity (nehojící se rány,…)
- otoky
- psychické změny, deprese, apatie
- změny v krevním, biochemickém obraze
= anémie (↓ Hb, Ht, erytrocyty), lymfopenie, ↑CK, hypoalbuminémie, ↓ Ig
- Hypoalbuminémie - ↓ jaterní produkce, ztráta bílkovin GIT, ledvinami
- snížení kalorického příjmu (pod 70 kcal/kg0.75 u Ca, 40 kcal/kg u Fe) po dobu 3-5 dní
- za předpokladu, že zvíře nebude schopno přijímat potravu po dobu delší než 2-3 dny z důvodu chirurgického zákroku
- při akutním úbytku hmotnosti o 5 % a více (po korekci hydratace pacienta) z důvodu hypermetabolických procesů
- při úbytku svalové hmoty o 8-10 %
- Podpora samovolného příjmu krmiva
- Násilné krmení
- Enterální krmení (nasoesophageální sonda, oesophagostomie - gatrostomie, jejunostomie)
- Parenterální krmení
- zahájit výživu během 24 hod od úrazu či hospitalizace
- podvýživa a stresové hladovění nastupují u pacientů v kritickém stavu, ve stresu či po úrazech během 3-5 dní
- klinické vyšetření, stabilizace, zhodnocení krevního a biochemického stavu nutná (specifické potřeby u pacientů s renálním selhání, …)
- pro pacienta nejméně stresující
- nejklidnější část ordinace
- termoneutrální prostředí (příjem krmiva klesá o 4 % na každé 2°C nad optimální teplotu)
- co nejchutnější krmivo
- zjistit potravní návyky zvířete od majitele
- stimulace apetitu medikamenty
- Ca – nositel chutnosti – živo. tuk, bílkoviny, někteří jedinci preferují sladkou chuť
- Fe – preferují vysoký podíl bíkovin a tuků (50 % a 40 % ME), málo CHO (do 10% ME)
- hovězí, vepřové, jehněčí preferováno vůči kuřecímu, koňskému (především u Fe je nejméně oblíbené kuřecí)
- konzervovaná a vařená strava preferována vůči granulované a syrové – paštiky, kousky v želé,…
- velikost kousků, granulí – dle velikosti pacienta (příliš malé – málo stimulují mastikaci a tvorbu slin, příliš velké - odrazují od uchopení)
- chuť, vůně – výrazná, ale ne extrémně nezvyklá (Fe – neofobie)
- krmivo ohřáto na tělesnou teplotu (↑ olfaktorických receptorů)
- načasování – Ca – stejná doba (Pavlovův reflex), Fe – malé porce několikrát denně – co 2 hodiny (lovec drobné kořisti)
- nabízení krmiva po krátkou dobu (10-20 min) – vždy čerstvé – zápach zasychajícího krmiva
- tvar, materiál použitých misek (Fe – ne malé, kruhové misky – dotyk hmatových chloupků okrajů misek)
- přítomnost majitele či naopak samota (pocit bezpečí – hl. u Fe – krytá záda a boky – použití krabice)
- Negativní vliv bolesti na příjem krmiva!
- stříkačkou, rukou přímo do tlamy
- špatně snášeno
- riziko vzniku averze ke krmivu – negativní asociace - přítomnost nauzey (pankreatitida, ketoacodóza, neoplazie, chemoterapie → Cerenia = maropitant –s.c. 1 mg/kg 1x denně), bolesti, stresu v době krmení
- pacient neschopen nebo neochoten k příjmu potravy = enterální či parenterální výživa
- preferované vůči parenterálním metodám (levnější, jednodušší, méně komplikací, přirozenější)
- přímá stimulace fce GIT (funkčnost a integriat střevní mukózy - ↓riziko bakteriální translokace a infekce)
- nasoesophageální sonda, osophagostomie (gatrostomie, jejunostomie)
- nejčastější (jednoduchá aplikace, relativně levná, stimulace celého GIT)
- pro krátkodobé použití – do 10 dnů
- u pacientů s fyziologickou dutinou nosní, farynxem, jícnem a žaludkem → po autoúrazechs pohmožděním čelisti, dutiny ústní, akutní epizoda chronického selhání ledvin, lipidózy jater,…
- Ne u zvracení, kómatu, ztrátě polykacího reflexu
- pro dlouhodobou enterální výživu – trauma či tumory dutiny ústní, čelistí, oesophageální dysfunkce, terminální fáze ledvinného selhání
- lze použít komerční krmiva rozmixovaná s malým množstvím vody
- v případě dysfunkce kraniální části GIT
- jejunostomie – elementární dieta - krmení s použitím pumpy (nepřetržitý přísun malého množství stravy, bolusové krmení není částo tolerováno), možno použít u pacienta s pankreatitidou (obchází žaludek i pankreas)
- riziko peritonitidy
- katabolismem bílkovin při traumatu, stresu
- zvracením, průjmem
- exsudací ran
- 2x více E než CHO a proteiny
- podpora zachování integrity bílkovin v tkáních (tuk přednostně využíván jako zdroj E)
- nositel chutnosti
- neesenciální → glukoneogeneze
- Výjimka: březí, laktující
- pacienti v kritickém stavu – 10-25 % CHO
- vitamín E, vitamín C, vitamín A, karoten, lutein, taurin,…
- specifické kombinace antioxidantů jsou schopny snížit poškození DNA a zvýšit imunitní odezvu organismu
- při závažných onemocněních, traumatu, hypovolemii, ischemii,…. → se zvyšuje množství volných radikálů → oxidační stres → peroxidace lipidů buněčné membrány buněčná smrt
- endogenní (glutation peroxidáza, superoxid dismutáza) a exogenní (vitamíny, minerály,..)antioxidanty
- RER (resting E requirements)
- Alternativa – zvláště u Fe (u Ca od 2-40 kg): RER = 30 x BW (kg)0.75 + 70 kcal/den
- dle krmných tabulek uvedených na obale
- vlastním výpočtem
- pro trauma můžeme zvýšit až o 50 = 900 ml/den
- o 25 % v případ pooperační péče
- o 50 % v případ mnohočetného traumatu
- o 20-50 % v případ infekce
- o 50-100 % v případ popálenin, trauma mozku
- vždy začít zvolna – adaptace GIT
→ z vypočítané KD – 30 % první den, následně zvýšení o 30 % každý den – pokud je množství tolerováno
- KD rozdělena do 4-6 porcí – podávána v rovnoměrných časových intervalech
- suplementace specifickými nutrienty vhodná až po stabilizaci (Zn+B vitamíny – u popálením, rozsáhlé poškození kůže, pankreatické enzymy, antioxidanty a B vitamíny – EPI, pankreatitida, lapače P – onemocnění ledvin,..)
- Zdroje bílkovin:
vepřové a drůbeží maso, vepřová a drůbeží játra, drůbeží/kuřecí moučka, sardinky, kukuřičný lepek, izoláty vepřových proteinů, kaseinát vápenatý (kasein), sušené vaječné bílky
- Zdroje sacharidů (jednoduché sacharidy, vláknina, prebiotika):
kukuřice/kukuřičná mouka, rýžová mouka
řepné řízky/ sušená řepná dužina
fruktooligosacharidy (FOS), mannan oligosacharidy (MOS)
- Zdroje tuků:
rybí olej, kuřecí tuk, slunečnicový olej
- Další přídavné komponenty:
minerální látky (chlorid draselný, uhličitan vápenatý, oxid hořečnatý, oxid zinečnatý, síran železnatý, oxid manganičitý, síran měďnatý x chelátově vázané minerální látky)
vitamíny a provitamíny (kyselina askorbová, vitamín E, cholin, thiamin, vitamín B12, pyridoxin, riboflavin, vitamín D, biotin, kyselina listová, beta-karoten)
aminokyseliny (methionin, taurin, glutamin)
lutein (extrakt z měsíčku lékařského, aksamitníku)
hydrolyzát z korýšů, hydrolyzát z chrupavek4. Specifita nutričních požadavků psů a koček trpících nádorovými onemocněními
Nádorová onemocnění se stala častou příčinou zdravotních potíží a úmrtí u domácích zvířat. Při rakovině dochází v těle k výrazným změnám-je narušen celkový metabolismus (zvýšené energetické nároky a rozvoj katabolismu). Správná výživa může výrazně zkvalitnit život onkologických pacientů!
Metabolismus nádorové buňky:
- Vyšší spotřeba glukózy -> vzniká vyšší množství pyruvátu -> vzniká vyšší množství laktátu (anaerobní glykolýza) -> rozvíjí se acidóza -> laktát do jater-> opětovný vznik glukózy (Coriho cyklus) -> opětovné využití nádorovou buňkou
- V Coriho cyklu dochází ke spotřebě ATP -> vysoké energetické ztráty
- Porovnání energetické bilance: Coriho cyklus – ztráta 4 molekul ATP versus Krebsův cyklus - zisk 38 molekul ATP
- narušený metabolismus glukózy vede ke změně v produkci inzulínu a glukagonu, rozvíjí se periferní rezistence buněk na inzulín (paradoxní hyperglykémie-hodně glukózy v krvi,která však nevstupuje do zdravých buněk a tyto „hladoví“)
Nádorová kachexie
- Je významnou součástí komplexu paraneoplastického syndromu.Můžeme vhodnou výživou částečně zmírnit !
- Katabolismu bílkovin z důvodu zvýšených energetických nároků (využití AMK k produkci glukózy v procesu glukoneogeneze). Snížené hladiny glycinu, glutaminu, valinu, cystinu a argininu.Zvýšené hladiny isoleucinu a phenylalaninu.
- Snížený příjem krmiva a další prohloubení vnitřního katabolismu a negativní energetické bilance (zvýšené hodnoty FFA, VLDL,TAG a ketolátek v krvi). Bylo zjištěno,že nechutenství souvisí s hyperglykémií (při hyperglykémii se do hypotalamu-centra pro regulaci příjmu potravy-dostává informace,která tlumí pocit hladu).
- Úbytek na váze v důsledku zvracení,průjmů, malabsorpce,... (také vedlejší efekt chemoterapie či radioterapie)
- Katabolismus bílkovin vede k hypoalbuminémii, snížení imunity, narušené funkce GIT, opožděnému hojení ran,...
Fáze nádorového onemocnění:
1. pacient nejeví klinické příznaky, pouze změny v biochemickém profilu (zvýšený laktát, inzulín, změny v profilu sacharidů, aminokyselin a lipidů-viz.výše)
2.objevují se první nevýrazné a nespecifické klinické příznaky-anorexie,ztráta hmotnosti,...
3.výrazné klinické příznaky- úbytek tukových zásob a svalové hmoty,velké oslabení organismu, apatie, negativní energetická bilance a převažující katabolismus,metabolická acidóza (ketolátky,laktát)
Pokud se takovýto stav neřeší, pacient umírá spíše než na samotný nádor na celkové oslabení a metabolický rozvrat!!!
Rakovina a obezita:
- obézní jedinci mají zvýšené koncentrace adipokinů v krvi
- adipokiny inhibují apoptózu a podporují angiogenezi>kancerogenní potenciál
- např. leptin vyvolal při pokusu in vitro nádory mléčné žlázy a jater (u lidí) – bylo prokazáno,že inhibuje expresi genu p53 (antionkogen)
Nutriční požadavky:
- dostatek energie:
- Výpočet pro množství potřebné energie:
- RER (resting energy requirement) x “illness factor”
- pes:
- RER (kilokalorie [kcal]/den) = 70 × (kg)0.75 tělesná hmotnost
- illness factor pro psy s rakovinou je 1.25 to 2
- kočka:
- RER (kcal/day) = 40 × body weight (kg)
- illness factor pro kočky s rakovinou je 1.25 to 2
-méně sacharidů (nepodávat ani infúzní roztoky obsahující laktát či glukózu !)
-více proteinů a tuků
- proteiny by měly ideálně pokrývat energetické nároky z 30-50%
- tuk by měl ideálně pokrývat energetické nároky z 50-60%
- kvalitní zdroje a dobrá stravitelnost + chuťově atraktivní!
- Aminokyseliny
- Arginin - pomáhá vytvářet NO v nádorové buňce, což vede ke zpomalení buněčného dělení, má vliv na imunitní systém (T-cell dependentní reakce- mechanismus není znám) > snižuje kancerogenezi a metastatický potenciál !
- Glutamin - imunostimulace, ochrana střeva před průnikem bakterií
- Aminokyseliny s rozvětveným řetězcem – leucin, isoleucin, valin- mají antiproteolytický efekt během kachexie (chrání svalovou hmotu a zvyšují syntézu bílkovin)
- glukoneogenní aminokyseliny (alanin, glycin, kyselina glutamová a asparagová)
- Oslabení nádorových buněk a tlumení zánětlivé reakce – snížení metabolismu kyseliny arachidonové a snížení tvorby mediátorů typu: TNFalfa, IL1 či PGE2 v nádorových buňkách (tento prostaglandin má vliv na progresi několika druhů rakovin)
- zejména EPA a DHA inhibují růst nádorových buněk-dochází k jejich inkorporaci do membrány nádorově pozměněné buňky>změna permeability>zvýšená náchylnost k poškození buňky
- rovněž dobrá prevence rakoviny (snížení zánětlivých reakcí v těle)
- Studie in vitro prokázaly výrazný inhibiční účinek EPA, gamma-linolenové kyseliny a konjugované linolové kyseliny na nádory močového měchýře, prostaty a osteosarkomy. Z nichž EPA má nejvýraznější vliv,který se však v kombinaci s ostatními omega 3- kyselinami dále potencuje.
- Antioxidanty
- Vit. E, C , selen, železo, zinek,karotenoidy
- prevence a léčba rakoviny + snížení nežádoucích účinků chemoterapie a radioterapie
- jeden protiargument: relativní protipůsobení antioxidačních účinků a efektu omega-3 kyselin na nádorovou buňku
5. Specifita nutričních požadavků psů a koček trpících kardiovaskulárním onemocněním
Poruchy kardiovaskulárního systému můžeme rozdělit na vrozené a získané. Mezi vrozené poruchy řadíme aortální a pulmonální stenózu, perzistentní ductus arteriosus a defekt komorového septa. Mezi získané poruchy řadíme chronickou nedostatečnost chlopní,dilatační kardiomyopatii a hypertrofickou kardiomyopatii.
Velkou roli v případě kardiovaskulárních potíží hraje rovněž plemenná predispozice:
Chronická mitrální insuficience se často vyskytuje např.u jezevčíků, kavalír king charles španělů, malých kníračů, yorkshire terierů, pudlů či čivav.
Dilatační kardiomyopatie se nejčastěji vyskytuje u velkých plemen psů, jako je dobrman, německá doga, bernardýn, irský vlkodav, boxer, novofundlandský pes a německý ovčák. Z malých plemen bývá někdy postižen kokršpaněl nebo buldok.
Hypertrofická kardiomyopatie se vyskytuje více u koček, zejména pak u plemene mainská mývalí a ragdoll.
Společným výsledkem špatné práce srdce je kongestivní srdeční selhání, které s sebou nese celou řadu zdravotních potíží jako je rozvoj anorexie a kachexie, dyspnoe, špatné okysličení tkání a tím narušená funkce orgánů a zvýšená tvorba volných radikálů (obecně hypoxie vyvolává poškození a obrannou reakcí těla na poškození je zánětlivá reakce).
Etiopatogeneze srdeční kachexie:
- zvýšená spotřeba energie v důsledku zvýšené práce srdečních a dýchacích svalů
- nižší perfúze tkání vede k tvorbě volných kyslíkových radikálů,které poškozují buňky a vedou k produkci zánětlivých cytokinů TNF a IL-1
- nechutenství
- častá příčina eutanázie!
- důsledek únavy, dyspnoe, léků, cytokinů
- nutné řešit! (zhoršení funkce imunitního systému, katabolismus vlastních bílkovin, rozvrat metabolismu atd.)
Kvalitní a vhodně zvolenou výživou můžeme výrazně zkvalitnit život pacienta!
Nutriční požadavky:
- obecné požadavky:
- méně iontů, které přetěžují srdce (sodík, chloridy)
- více iontů, které chybí (draslík, hořčík)
- dostatek antioxidantů
- udržení dobré kondice (energie – karnitin, MK)
- snížit příjem sodíku-nekrmit potraviny bohaté na obsah soli (zejména uzeniny, maso-nejvíce sodíku v drůbežím a nejméně v hovězím mase,různé polotovary, sýry,...)
- pozor na přílišný pokles sodíku v těle – kombinace léčby pomocí ACE inhibitorů (↓ retence Na v důsledku přerušení systému renin-angiotenzin-aldosteron), diuretik ( ↑exkrece Na v důsledku ↑diurézy) a diety se sníženým obsahem sodíku > pradoxně dochází k aktivaci RAAS a ↑zadržování v těle
- AAFCO doporučená minimální hodnota obsahu sodíku:pes-0,06 % v sušině, kočka-0,20 % v sušině
- chloridy
- suplementace chloridů může přispívat k inhibici RAAS
- furosemid ovlivňuje transport chloridů a sodíku ve vzestupném raménku Henleyho kličky a přispívá k hypochlorémii a hyponatrémii,což vede k aktivaci RAAS a prohlubování chronického selhávání
- AAFCO doporučená minimální hodnota obsahu chloridů:pes-0,09 % v sušině, kočka-0,03 % v sušině
- hypokalémie je spojená se svalovou slabostí a rozvojem arytmií
- hyperkalémie je však rovněž nebezpečný stav i pro pacienta se zdravým srdcem!-při srdečních onemocněních se dává přednost infúzím obsahující čistě NaCl
- ACE inhibitory a spironolakton (draslík šetřící diuretikum) přispívají k rozvoji hyperkalémie
- je potřeba pravidelně kontrolovat hladinu draslíku,protože má výrazný vliv na práci srdce a jak hyperkalémie,tak hypokalémie vedou k narušené práci myokardu
- AAFCO doporučená minimální hodnota obsahu draslíku:pes-0,60 % v sušině, kočka-0,60 % v sušině
- výrazný vliv na celý kardiovaskulární systém, činnost myokardu a rozvoj arytmií
- koenzym enzymů kináz>spousta metabolických drah v těle
- antagonista vápníku
- Minimální doporučená dávka dle AAFCO:pes-0,04 % v sušině, kočka-0,04 % v sušině
Poznámka: Fyziologie nervového přenosu na myokardu je založena na spolupráci sodíku,draslíku a vápníku (doprovodně též chloridů a hořčíku). Proto je nutno tyto ionty držet v maximální možné rovnováze.
- proteiny
- potřeba dodávat dostatek kvalitních bílkovin (prevence odbourávání vlastních bílkovin, zdroj důležitých aminokyselin), ale ne nadbytek (zátěž jater, ledvin)
- minimální obsah bílkovin v sušině dle AAFCO pro psy 18%, pro kočky 26% (2/3 by měly pocházet z živočišného zdroje)
- pro kočky je esenciální
- zdroj NO > relaxace cév a regulace krevního tlaku > snížení nároků na práci srdce
- antitrombotický efekt
- důležitý pro správnou funkci srdce (ovlivňuje metabolismus vápníku, kontraktilitu myokardu, má antioxidační vlastnosti)
- deficit vede zejména k rozvoji dilatační kardiomyopatie
- esenciální pro kočky
- v těle vzniká z aminokyselin cysteinu a methioninu pomocí vitamínu B6
- vyšší potřeba je popsána u některých plemen (například americký kokršpaněl, dalmatin, labradorský retrívr,bernardýn,anglický setr,Newfoundland,aj.
- deficience taurinu byla popsána při krmení kombinace jehněčí+rýže a krmiva bohatého na sojové boby či vlákninu
- přemnožení bakteriální mikroflóry v tlustém střevě vede ke zvýšeným ztrátám taurinu ve výkalech
- Doporučená dávka taurinu:psi – 0,1 % v sušině,malí psi (do 25 kg) → 500 to 1000 mg 3xdenně, velcí psi (nad 25kg) → až 2 g 2-3xdeně, kočky - 0,3 % v sušině = 250-500 mg za den
- L-karnitin se zařazuje mezi tzv. vitageny
- dobrým zdrojem je syrovátka
- v těle vzniká z aminokyselin lyzinu a methioninu
- L-karnitin je látkou dosti citlivou: v přítomnosti redukčních látek (např. askorbová kyselina) se rozkládá
- nutný pro metabolismus mastných kyselin (napomáhá transportu MK do mitochondrie) a produkci energie
- antioxidační vlastnosti, napomáhá odstraňovat z mitochondrie MK se středně dlouhým a krátkým řetězcem
- deficit vede k rozvoji onemocnění myokardu, zejména dilatační kardiomyopatie
- primární deficit vzniká v důsledku narušené syntézy, vstřebávání, transportu či nadměrné degradace (geneticky podmíněné)
- sekundární deficit vzniká při nedostatečné výživě, byl pozorován u vegetariánů
- Doporučené dávkování :obecně 0,02% v sušině, psi s DCM - 50 - 100 mg/kg co 8 hodin
- nenasycené omega-3 mastné kyseliny (EPA, DHA) mají antiarytmický účinek (regulují vstup sodíku a vápníku do buněk)-u psů s chronickým srdečním selháváním byly naměřeny snížené hladiny EPA a DHA v krvi
- napomáhají snížení produkce cytokinů (jedna z příčin srdeční kachexie) a jsou zdrojem energie (zlepšení kondice) + srdeční sval získává až 60 % energie oxidací mastných kyselin!
- antitrombotické vlastnosti (snížená syntéza tromboxanů)
- dobrým zdrojem je rybí olej
- Doporučené dávky:25 mg/kg EPA A 18 mg/kg DHA (40 mg/kg EPA a 25 mg/kg DHA při anorexii a kachexii)
- obecně platí, že maximální množství tuků by nemělo být vyšší než 70% ME, 33% v sušině (riziko průjmů,zhoršené vstřebávání proteinů,jódu,vitamínu B1,riziko pankreatitídy,...)
- antioxidanty
- chronické srdeční selhávání je spojeno se zvýšeným množstvím kyslíkových radikálů (oxidační stres)-snížená perfúze tkání kvůli srdeční nedostatečnosti+snížené koncentrace v tuku rozpustných antioxidantů
- vitamin C, vitamin E, koenzym Q10
- B vitamíny
- terapie diuretiky vede ke zvýšeným ztrátám vitamínů rozpustných ve vodě-zejména vitamíny skupiny B
http://ajcn.nutrition.org/content/73/4/673.full
http://www.veterinaryworld.org/Vol.2/December/Review%20on%20Nutritional%20Management%20of%20Cardiac%20Disorders%20in%20Can.pdf
6. Specifita nutričních požadavků psů a koček trpících onemocněním vylučovacího systému
Nejčastější problémy vylučovacího systému zahrnují akutní selhání ledvin, chronické selhávání ledvin a urolitiázu.
Chronické renální selhání (CRH=Chronic Renal Failure)
Je to progresivně se zhoršující stav ledvin. Klinické příznaky jsou patrné obvykle až když je funkční již pouze 25% ledvinné tkáně (75% parenchymu je poškozeno a nefunguje). Dochází ke hromadění metabolitů v těle zvířete-zejména močoviny a kreatininu (tzv. azotémie). Je narušena homeostáza vody, minerálních látek (sodík,draslík,vápník),pH. Dochází k rozvoji anémie (snížená tvorba erytropoetinu). Je rovněž narušen syntetický cyklus vitamínu D. Příčina tohoto stavu je multifaktoriální (trauma,infekce,ukládání imunokomplexů, amyloidóza, neoplazie, snížená perfuze ledvin, toxické poškození-etylenglykol,hroznové víno,aj., léčiva-NSAID,ATB,... atd.).
Ukazatelé CRH:
- polyurie,polydipsie
- ↓koncentrační schopnost ledvin > ↓specifická hmotnost moči
- proteinurie
- anorexie, zvracení, slabost
- uremický zápach
- uremická stomatitis (zánět až nekrózy v dutině ústní)
- anémie (↓ Hb, Ht, erytrocyty)
- ↑ urea
- ↑ kreatinin
- ↑ fosfor (↑ fosfor vede k rozvoji tzv. sekundárního renálního hyperparathyroidismu = zvýšená funkce příštítných tělísek=zvýšená produkce parathormonu>demineralizace kostí, případně až mineralizace měkkých tkání
- ↑ cholesterol a TAG(triacylglyceroly)
Specifita nutričních požadavků:
- BÍLKOVINY: adekvátní množství kvalitních bílkovin-vysoké množství bílkovin zatěžuje ledviny a celý organismus, nízkoproteinová dieta však rovněž není vhodná (organismus je nucen čerpat z vlastních zásob, dochází ke katabolismu svaloviny -tělo potřebuje denně přijímat určitý podíl bílkovin,jinak dochází k nedostatku potřebných proteinů a aminokyselin), doporučená dávka pro psa je 2,0-2,2 g/kg ž. hm. a pro kočku 3,0-3,5g/kg ž.hm.
- VLÁKNINA: napomáhá exkreci dusíkatých látek a snižování močoviny v krvi, napomáhá nastolit správnou střevní mikroflóru,která se mj. účastní i dusíkatého metabolismu v těle
- FOSFOR: doporučován je snížený obsah fosforu (pozor na vysoký obsah fosforu v mase-upřednostnit mléčné a vaječné zdroje bílkovin)
- TUKY: dieta bohatá na polynenasycené mastné kyseliny, zejména omega-3, má pozitivní vliv na hladinu triacylglycerolů v krvi a hodnotu krevního tlaku
- SODÍK: dieta bohatá na sodík (uzeniny,...) má nepříznivý vliv na stav ledvin,protože přispívá k hypertenzi,aktivaci RAAS a zhoršené perfuzi ledvin
- HYDROGENUHLIČITAN SODNÝ, CITRÁT DRASELNÝ: napomáhají regulovat pH krve a upravovat metabolickou acidózu
Urolitiáza
Je to přítomnost konkrementů (urolithů) ve vývodných močových cestách
▫ v ledvinné pánvičce (nefrolithiasis)
▫ v močovodu (ureterolithiasis)
▫ v močovém měchýři (cystolithiasis)
▫ v močové trubici (uretrolithiasis)
Dle složení rozlišujeme různé druhy urolithů:
▫ STRUVIT (fosforečnan hořečnato-amonný)
▫ KALCIUM OXALÁT (šťavelan vápenatý)
▫ AMMONIUM URÁT (močan amonný)
▫ CYSTIN
▫ KALCIUM FOSFÁT
▫ KŘEMIČITANY
Poznámka: Velká většina urolithů má komplexní složení - analýzou se zjistí více typů sloučenin v rámci jednoho urolithu.
Etiopatogeneze:
1) Relativní supersaturace = nadměrné množství určité látky
2) Nukleace=shlukování částic dané látky
3) Růst krystalu
a) vliv pH
▫ kyselé>velká většina urolithů
▫ zásadité (vzniká při bakteriálních infekcích-působení ureáza pozitivních bakterií např. Proteus spp., Staphylococcus spp.) > struvity
b) retence moči
c) plemenné predispozice-dalmatin (urátové kameny), Newfoundland (cystinové kameny)
d) pohlaví-vyšší prevalence u samců (pouze struvity převažují u samic-vyšší náchylnost k infekcím UPS)
e) otravy-rostliny bohaté na šťavelany,etylenglykol,rozinky,lilie,...
f) různé metabolické a endokrinní dysfunkce (zvýšená hladina močoviny při hepatopatiích či nefropatiích,atd.)
g) elektrolytové dysbalance (hyperkalcémie, hypermagnezémie,hyperfosfatémie, hyperurikémie,...)
h) nevyvážená strava + nízký příjem tekutin
VLIV NA ZDRAVÍ ZVÍŘETE:
- Iritace UPS > záněty (pyelonephritis, ureteritis, cystitis, urethritis)
- syndrom FLUTD u Fe (zejména kocourů)=souhrnné označení pro skupinu onemocnění, která způsobují zánět v „dolních cestách močových“ (Feline Low Urinary Tract Disease)
- Riziko obstrukce ledvin>selhání ledvin, azotémie
- Riziko obstrukce urethry (vyšší u samců)
Ukazatelé urolitiázy:
- hematurie
- dysurie
- polakisurie,oligurie, anurie
- krystalurie
Nutriční podpora:
1) zvýšit příjem tekutin (namáčet granule,…)
2) pozměnit pH
- zvýšení pH (alkalizace) pro terapii kalcium oxalátových,cystinových a urátových kamenů-citrát draselný
- snížení pH (acidifikace) pro terapii struvitových kamenů-methionin, chlorid amonný
- kalcium oxaláty - dietou je nerozpustíme,ale můžeme jim předcházet !
- riziko formace jiných typů kaménků při nepřiměřeném podávání-riziko nadměrné acidifikace či alkalizace a vytvoření opačného problému!
- většina obilovin obsahuje vysoké množství draselných solí, které alkalizují moč (výjimkou je kukuřičné zrno, které obsahuje hodně sirných aminokyselin)
3) vyvážený příjem bílkovin a minerálů
- dostatek bílkovin a AMK (dříve doporučována nízkobílkovinná dieta, nyní již překonané)
- snížit příjem hořčíku a fosforu u struvitových kamenů
- snížit příjem vápníku a sodíku u kalcium oxalátových kamenů
4) omezit příjem purinů (vnitřnosti) v případě urátových krystalů-upřednostnit mléčné a vaječné zdroje bílkovin
5) v případě kalcium oxalátových kamenů se vyhnout potravinám bohatých na šťavelany (špenát,rebarbora,petržel,...)
Existují 2 typy diet:
a) pro přímé rozpouštění kamenů (kalkulolytické diety)
▫ Kalcium oxalát, kalcium fosfát, křemičitany – nelze
▫ Struvity- reagují poměrně dobře společně s ATB terapií (prokazána infekce)
b) pouze doplněk k chirurgickému odstranění kaménků a k prevenci recidivy
- POZOR: speciální diety na rozpouštění vs. preventivní program (speciální diety na rozpouštění se nesmí podávat dlouhodobě jako běžné krmení)
Výběrem vhodné diety můžeme předcházet tvorbě urolithů, případně je i přímo redukovat!
V rámci zkrmování určité diety je důležité průběžně kontrolovat stav pacienta a pravidelně provádět urinalýzu.
Je nutno si uvědomit,že některé urolithy budou vznikat stále (vrozená porucha metabolistmu,...),zatímco jiné můžeme vhodnou dietou výrazně zredukovat (úprava pH,...).
7. Specifita veterinárních diet pro psy, kočky trpících endokrinními poruchami
Výživa psů a koček trpících endokrinním onemocněním
Diabetes mellitus
Diabetes mellitus je polyfaktoriální onemocnění, způsobené absolutním nebo relativním nedostatkem inzulínu, jehož hlavním důsledkem je hyperglykémie. Etiologicky se DM dělí na primární a sekundární. Primární DM je způsoben destrukcí B-buněk pankreatu, sekundární vzniká jako důsledek periferní resistence tkání na inzulín. Novější klasifikace dělí DM podle potřeby aplikace inzulinu na: diabetes mellitus závislý na podání inzulinu (IDDM = insulin depend diabetes mellitus) a diabetes mellitus nezávislý na podání inzulinu (NIDDM = non-insulin depend diabetes mellitus). Podle tohoto členění patří většina kočičích a psích diabetiků do skupiny I. u níž je aplikace inzulínu nezbytná. Častěji bývají postiženy nekastrované feny. Zvýšená hladina endogenních nebo exogenních gestagenů způsobuje zvýšené uvolňování STH z mléčné žlázy a tím snižuje efekt inzulínu na glukózu. Z toho plyne, že na utilizaci stejného množství vstřebaných sacharidů je třeba mnohem více inzulínu. Dochází k hypertrofii B-buněk. Pokud tento stav přetrvává déle než 2 – 3 týdny, dochází k únavě buněk, jejich degeneraci až atrofii. Glukokortikoidy jsou látky, které zvyšují periferní rezistenci tkání na inzulín. Na toto je třeba pamatovat při léčbě pacienta s hyperadrenokorticismem (i iatrogenním). V důsledku akutní pankreatitidy může být kromě exokrinní části zasažena i ta endokrinní. Tento stav se projeví hyperglykemií, která je obvykle přechodná. Primární DM způsobený destrukcí (autoimunitní) Langerhansových ostrůvků se vzácně objevuje u mladých jedinců. Plemenná predispozice byla zjištěna u pudla, německého ovčáka a jezevčíka. U koček se plemenná predispozice neuvádí, snad s výjimkou kočky barmské.
Obezita koček, ale také psů je významným rizikovým faktorem pro vznik DM. Obézní jedinci mají zvýšenou periferní rezistenci na inzulín, způsobenou jeho nedostatečnou vazbou na receptory.
Symptomatologie
DM postihuje přibližně dvakrát častěji feny než psy (vliv endogenních a exogenních gestagenů). Onemocnění se objevuje ve středním a vyšším věku, nástup je postupný. U koček je situace opačná – nejvíce postižených jedinců jsou samci nebo kastráti vyššího věku. Onemocnění se manifestuje ze dne na den, zpravidla syndromem PU/Pd.
Mezi nejčastější příznaky onemocnění patří polydipsie, polyfagie, ztráta hmotnosti a snížená aktivita. Další příznaky zahrnují zhoršenou kvalitu srsti, hepatopatii, kataraktu (častější u psů), slabost pánevních končetin (častější u koček) a dehydrataci. Hyperglykémie a hyperlipidémie patří mezi nejčastější laboratorní nálezy. Zvýšená koncentrace glukózy v plazmě vyvolává glykosurii v případě překročení ledvinného prahu pro glukózu. U psa je tento práh 10 – 12 mmol/l, u kočky 14 – 16 mmol/l. Zvýšená diuréza vyvolá zvýšený příjem tekutin – polydipsii a je doprovázena sníženými hladinami sodíku, fosforu a draslíku.
Diagnostika
Diagnostika je založena klinických příznacích, stanovení glukózy v krvi a moči, popřípadě provedení glukózo-tolerančního testu. U koček stanovujeme v krvi hladinu fruktosaminu (u koček je častá hyperglykémie z důvodu stresu).
Léčba
Léčba diabetu spočívá v medikamentózní terapii a dietních opatření. Pokud DM postihne nekastrovanou fenu, je vhodné u ní po proběhlém cyklu provézt ovariohisterektomii. Základem terapie je injekčně aplikovaný insulin nebo sulfonylurea podávaná perorálně. Uvádí se, že perorální antidiabetika u psa nemají moc velký efekt. Cílem inzulínové terapie je stabilizovat hladinu glukózy.
Dietární doporučení
- krmivo bychom měli rozdělit minimálně do dvou dávek
- podávat ve stejnou denní dobu
- rozestup mezi krmením by měly být cca 7,5 hodiny
- cílem diety je dosažení optimálního výživného stavu pacienta
- častá komplikace - pankreatitida
- pokud je pes obézní, měla by být hmotnost korigována -tím dojde ke snížení inzulinové rezistence a lepší kontrole diabetického stavu
- krmiva určená pro obézní psy obsahují zvýšené množství vlákniny
- kachektickým a hubeným psům podáváme udržovací diety se sníženým množství vláknin
- u koček je obezita běžnou komplikací DM - diabetické kočky se mohou stát po snížení hmotnosti na inzulinu nezávislé
Doporučené hodnoty parametrů krmiva pro psa trpícího IDDM/NIDDM
Voda – čerstvá a čistá, dostupná po celý den
Lehce stravitelné cukry – vyhnout se jednoduchým cukrům, poskytovat krmivo s obsahem lehce stravitelných cukrů ne vyšší než 55%.
Vláknina – krmivo by mělo obsahovat 7 – 18% vlákniny
Tuky – méně než 25%
Proteiny – 15 – 35%, psi trpící renálním selháním by měli být krmeni krmivem s obsahem proteinů na spodní hranici rozmezí
Forma předkládaného krmiva – vyhnout se vlhčené stravě
Krmivo pro kočky trpící diabetem - krmivo s vyšším obsahem vlákniny
Voda – čerstvá a čistá, dostupná po celý den
Lehce stravitelné cukry – vyhnout se jednoduchým cukrům a škrobu, poskytovat krmivo s obsahem lehce stravitelných cukrů ne vyšším než 40%.
Vláknina – krmivo by mělo obsahovat 7 – 18% vlákniny
Tuky – méně než 25%
Proteiny – 28 – 55 %, kočky trpící renálním selháním by měly být krmeny krmivem s obsahem proteinů na spodní hranici rozmezí
Forma předkládaného krmiva – vyhnout se vlhčené stravě
Krmivo pro kočky trpící diabetem - snížené množství sacharidů, vysoký obsah proteinů
Voda – čerstvá a čistá, dostupná po celý den
Lehce stravitelné cukry – vyhnout se jednoduchým cukrům a škrobu, poskytovat krmivo s obsahem lehce stravitelných cukrů ne vyšší než 20%.
Vláknina –
Tuky – méně než 25%
Proteiny – 28 – 55 %, kočky trpící renálním selháním by měly být krmeny krmivem s obsahem proteinů na spodní hranici rozmezí
Forma předkládaného krmiva – vyhnout se vlhčené stravě
Hypotyreóza
Hypotyreóza je onemocnění charakterizované nedostatkem hormonů štítné žlázy. Vyskytuje se většinou u psů, u koček je její výskyt vzácný. Může postihovat jak štěňata, tak dospělé psy. Většina hypotyreozních stavů u štěňat je vrozených, nicméně se mohou vyskytnout i stavy získané. Získaná hypotyreóza se může vyvinout při krmení krmivem deficitním na jod (např. krmení jen masem a vnitřnostmi bez doplňků). Doma připravovaná potrava nebo krmiva průmyslová nejsou deficitní na jod, tudíž by k rozvoji strumy dojít nemělo.
Hypotyreoza dospělých psů je daleko častější než je tomu u štěňat. Rozlišujeme podle lokalizace změn primární, sekundární a terciární hypotyreozu, kdy primární hypotyreóza je nejčastější (95%). Nejčastěji je způsobena autoimunitně lymfocytární infiltrací nebo idiopatickou atrofií štítné žlázy.
Klinické příznaky
Hypotyreóza mláďat se projevu zaostáváním v růstu a vývoji. Hlava je v porovnání k tělu větší, objevuje se hypotermie, snížená motorická aktivita, porucha v sání mateřského mléka, zvětšená dutina břišní a neuzavřené fontanely.
Hypotyreoza u dospělých psů propuká většinou plíživě. Vyskytuje se u psů mladšího až středního věku, vliv pohlaví nebyl prokázán. Byla zjištěna určitá plemenná predispozice – retrívr, dobrman, rotvajler, jezevčík, boxer, německý ovčák, pudl. U dospělých psů se onemocnění projeví změnami chování a aktivity, dermatologickými abnormalitami a slabostí pánevních končetin. Časem se projeví mentální otupělost, apatie, neschopnost cvičit a sklon k tloustnutí ačkoliv se snižuje chuť k příjmu krmiva.
Klasické kožní projevy zahrnují symetrické nepruritické alopecie začínající na hřbetě s tendencí šíření na hlavu a končetiny. V počátečních stadiích onemocnění se mohou vyskytovat alopecie jen na ocase, tzv. krysí ocas (rat tail). Komplikací kožních změn bývají seborea a pyodermie. Srst psů je matná, suchá a snadno vypadává. Obnova chlupů trvá dlouho. Často se objevuje hyperpigmentace a hyperkeratóza.
Nervové příznaky mohou postihovat jak centrální tak periferní nervový systém. Klinické projevy zahrnují záchvaty, ataxii, pohyb v kruhu, vestibulární příznaky nebo faciální nervovou paralýzu.
Diagnóza
Diagnóza se odvíjí od klinických příznaků a laboratorního stanovení celkového T4 v séru nebo plazmě. Krev odebíráme po nejméně 12ti hodinové hladovce. Hladina T3 se nestanovuje z důvodu jeho snížené hladiny vlivem autoprotilátek.
Léčba
- perorální podávání syntetického L-tyroxinu (levotyroxin sodný)
- při vhodné léčbě jsou všechny příznaky reverzibilní
- ke zlepšení mentálních funkcí a aktivity dochází zpravidla během prvního týdne, kvalita srsti se zlepší v průběhu měsíce, neurologické potíže však mohou přetrvávat delší dobu
- lék je nutno podávat pacientovi doživotně
Dietární doporučení
- řadu komplikací tohoto onemocnění je možno zvládnout výběrem vhodné diety
- psi s hypotyreozou mají snížený bazální metabolismus - což zvyšuje riziko nadváhy nebo obezity
- léčba levotyroxinem sodným pomůže snížit hmotnost, ale tento efekt nemusí být dostatečný - vhodné podávat pacientovi krmivo s nižším obsahem energie ale vyšším obsahem proteinů (ochrana před ztrátou svalové hmoty)
- souběžné kožní problémy - nenasycené mastné kyseliny, vitamíny skupiny B, vitamín E, vitamín A, zinek a selen
- mastné kyseliny spolu s beta-glukany podporují tvorbu eikosanoidů a cytokinů, tím zlepšují imunitní odpověď organismu
- i když nebyla prokázána souvislost mezi hypotyreozou a srdečním onemocněním, hypotyreoza může již existující srdeční selhání zhoršit
- z toho důvodu by měla dieta obsahovat zvýšené množství taurinu, L-karnitinu a omaga–3–mastných kyselin
- činnost štítné žlázy narušují i tzv. strumigenní látky
Hypertyreóza
Hypertyreóza je multisystémové onemocnění vyplývající ze zvýšené produkce a sekrece hormonů T3 a T4 štítnou žlázou. Příčinou hypertyreózy jsou u obou druhů zvířat neoplastické změny tyreoidálních epiteliálních buněk. U koček se jedná většinou o adematózní hyperplazii nebo adenom. U psů se bohužel většinou setkáváme s karcinomy.
Klinické příznaky
Hypertyreóza je nejčastější onemocnění koček starších osmi let (průměrný věk 13 let). U tohoto onemocnění nebyla prokázána pohlavní predispozice. Domestikované a krátkosrsté a dlouhosrsté kočky jsou nejčastěji postiženými plemeny. U siamských a himalájských koček je zvýšené riziko vzniku hypertyreózy.
Nejčastějšími klinickými příznaky jsou ztráta hmotnosti, polyfagie, nervozita nebo hyperaktivita. Dochází také ke zhoršení kvality srsti (nesouměrné alopecie, rozcuchaná srst, ztráta péče o srst). Dále se objevuje polyurie, polydipsie, zvracení a průjem. Zvířata bývají vystrašená, se zvýšeným tonem kosterního svalstva a jsou vnímavější k působení stresorů. Běžné konkurenční problémy u koček s hypertyreozou jsou tyreotoxická kardiomypatie, zvýšená aktivita jaterních enzymů, systémová hypertenze a nedostatečnost ledvin. Kardiomyopatie, zvýšená aktivita jaterních enzymů a systémová hypertenze jsou reverzibilní po zahájení terapie. Nedostatečnost ledvin je běžné onemocnění starších koček a často se vyskytuje s hypertyreózou současně. Hypertyreoza často zvyšuje glomerulární filtraci, která může maskovat biochemickou a klinickou manifestaci selhání ledvin.
Hypertyreóza u psů postihuje zvířata středního a vyššího věku (průměrně 7,5 až 9 let). Vyšší výskyt se objevuje u plemene boxer. Vliv pohlaví se neuplatňuje.
U psů jsou klinické příznaky shodné s kočkami, avšak nebývají tak výrazné. Je třeba ještě poznamenat, že vlastní projevy hypertyreózy mohou být maskovány komplikacemi probíhajícího nádorového bujení.
Diagnostika
Na onemocnění nás můžou upozornit klinické příznaky, kterých si povšimne majitel. Palpací ventrální strany krku můžeme zjistit zvětšenou štítnou žlázu (bilaterálně nebo unilaterálně). RTG vyšetření je vhodné na vyloučení metastatického rozsevu do plic. Laboratorní diagnostika spočívá ve stanovení celkového tyroxinu. Z dynamických funkčních testů je možno využít tyroninový supresní test.
Léčba
Léčba tohoto onemocnění spočívá v chirurgickém odstranění zvětšené žlázy, destrukci žlázy pomocí radioaktivního jodu nebo aplikaci látek s antityroidálním účinkem.
Dietární opatření
- výskyt syndromu PU/Pd - dostatečné množství vody
- kočka s neléčenou hypertyreózou vykazuje výrazný katabolismus vlivem nadbytku hormonů = zvířata výrazně podvyživená
- po úspěšné léčbě onemocnění je třeba poskytovat potravu odpovídající energetické a nutriční denzity k navrácení zvířete do vyhovujícího výživného stavu (BSC 3/5)
- krmení vlhkým krmivem nebo přidání vývaru do krmení může zvýšit příjem jak tekutin tak potravy
- na nové krmivo přecházet postupně (1. den nahradit 25% původního krmiva krmivem novým, druhý den polovinu, třetí den 75% a čtvrtý den už podávat nové krmení
- nezkonzumované vlhké krmivo je třeba po 2 až 4 hodinách z misky odstranit
- v době rekonvalescence je vhodné podávat krmivo s vyšším podílem energie a proteinů, k urychlení návratu požadované tělesné kondice - pozor je třeba dávat na možné probíhající selhání ledvin
- v poslední době se objevuje nová varianta hypertyreózy psů a koček postihující i mladá zvířata. Krmení syrovým masem, např. BARF dieta - někdy zahrnuje i zkrmování částí krků (štítné žlázy nejsou vždy z tohoto krmiva odstraněny - denní zkrmování krků pak může vést k rozvoji “hypertyreózy” se sekundárním poklesem TSH a možnou atrofií štítné žlázy
- na trhu ČR dostupná dieta založená na restrikci jódu
8. Specifita nutričních požadavků psů a koček trpících GIT poruchami
Specifita nutričních požadavků psů a koček trpících GIT poruchami
Onemocnění periodontu
Mezi nejčastější onemocnění postihující dutinu ústní psa a kočky můžeme bezesporu zařadit onemocnění periodontální (60-80%). Jsou to plakem podmíněná zánětlivá onemocnění. Nejdříve dochází k rozvoji gingivitidy, zánětu dásní, což je vratný proces. Nebude – li však zahájena patřičná terapie proces progreduje až k onemocnění peridontu.
Infekce periodontu je spojována se zvýšenými hladinami C-reaktivního proteinu, prozánětlivých cytokinů, cholesterolu, plazmatického fibrinogenu, bílých krvinek a krevní glukózy. Malá, toy a brachycephalická plemena jsou více náchylná na různé vady skusu, což zvyšuje riziko pro akumulaci zubního plaku. Navíc jsou brachycephalická plemena predisponována k dýchání ústy, tudíž dochází k neustálému zvlhčování a iritaci orální sliznice. Nemoci peridontu, resorpce zubu a gingivostomatitida jsou četnější u čistokrevných plemen koček, zejména asijských plemen. Věk zvyšuje náchylnost k onemocnění u psů i koček.
Etiologie
Úvodní fáze tvorby plaku je tvořena formací zubního povlaku – pelikuly. Pelikula je tvořena z glykoproteinů a proteinů pocházejících ze slin a tekutiny dásní. Začíná se formovat na čistém zubním povrchu během několika minut. Tato tenká vrstva ulpívá na povrchu zubu převážně elektrostatickými silami mezi negativně nabitými fosfátovými skupinami v molekule hydroxyapatitu a pozitivně nabitými složkami slin a tkáňové tekutiny v dásních. Z počátku pelikula chrání a lubrikuje povrch zubu. Avšak debris a plak tvořící bakterie, které jsou běžnou součástí dutiny ústní, začínají velmi rychle adherovat na pelikuly a množit se. Během 24 hodin pokrývá hladká vrstva plaku celý zub. Nově tvořený plak je měkká, želatinozní hmota tvořená bakteriemi, jejich metabolickými produkty, detritem a složkami slin. Nejsilnější vrstva se usazuje u dásně na bázi zubu. Důvodem je to, že zde nedochází k samovolnému čištění při mastikaci. Pokud ponecháme aerobní a fakultativně anaerobní bakterie volně množit, vrstva plaku postupně zesiluje a stává se obtížněji slupitelnou z povrchu zubu. Nejčastější bakteriální původci jsou G+ fakultativní patogeny jako Actinomyces sp, Streptoccocus sp. U psů jsou navíc často nacházeny Porphyromonas: P. gluae, P. salivosa a P. denticans.
Zubní plak slouží jako organická matrix pro následnou mineralizaci. Precipitace minerálních solí nastupuje do dvou týdnů od vytvoření plaku. Zubní kámen je drsná, porovitá struktura, pokrývající povrch zubu. Je tvořen ve vrstvách. U psů se v něm často nachází chlupy a zbytky potravy. Minerální látky tvořící supragingivální zubní kámen pochází ze slin, subgingivální plak je tvořen z minerálů tkáňové tekutiny. Nejčastěji se jedná o uhličitan vápenatý a fosforečnan vápenatý. Zubní kámen není sám o sobě považován za patologické agens. Udržuje však plak v kontaktu s dásní což přispívá k iritaci sliznice a narušuje samočisticí schopnost zubu.
Gingivitida je způsobena supragingiválním plakem. Kontakt plaku a sliznice vede k jejímu poškození a následně k zánětlivé odpovědi organismu. Rozšiřováním plaku (subgingivální plak) pod sliznici dásně vede ke vzniku dásňového sulku. Pokud tento stav nebude léčen, dochází k progresi procesu v tzv. periodontální kapsu. Substance, která se nachází v této kapse je tvořena neadherovaným plakem a bakteriemi. Jsou to především G+,fakultativní druhy a některé druhy G-. Jelikož tyto bakterie utilizují kyslík, podporují tím růst anaerobních bakterií.
Onemocnění peridontu se rozvine pokud vystavíme periodontální vazy účinkům plaku, bakterií a bakteriálním produktům. Je to tedy plakem vyvolané, progresivní zánětlivé onemocnění postihující dáseň, pojivou tkáň mezi kořenem zubu a zubní jamkou a alveolární kost. Podpůrná pojivová tkáň a okolní kosti slábnou a může dojít ke ztrátě zubů. Onemocnění peridontu jako takové vede k diskomfortu a bolesti. Pokud není léčeno může dojít k proniknutí bakterií do krve a rozvoji vážnějších zdravotních komplikací například k bakteriální endokarditidě. Bylo zjištěno, že psi s vážnými příznaky onemocnění měli po žvýkání žrádla zvýšené množství bakterií v krvi.
Mezi hlavní klinické příznaky můžeme zařadit zápach z úst, krvácející, zarudlé dásně, ztrátu zubů a potíže s příjmem potravy spojené s bolestivostí a ulcerace na sliznici.
Prevence
Jako nejúčinnější prevenci doporučují veterinární lékaři čištění zubů kartáčkem každý den nebo každý druhý den. Čištění je vhodné spojit s nějakým příjemným prožitkem (například posledním večerní procházkou). Jako vhodný kartáček je nejjemnější kartáček značky Curaprox. Hlavici se štětinami je třeba po namočení do horké vody vytvarovat. Používáme dětskou zubní pastu nebo speciální pastu pro psy na čištění zubů.
Pokud není čištění zubů možné lze využít tyto prostředky:
- výplachy dutiny ústní (např. MaxiGuard Oral Cleansing Spray or CET Oral Hygiene Rinse).
- dentální ubrousky (Detacetic wipes)
- aditiva do pitné vody ((Biotene nebo Petrodex)
- antimikrobiální agens jako chlorhexidine digluconate
Některá krmiva pro psy a kočky byla navržena, aby usnadňovala odstraňování plaku ze zvířecích zubů. Veterinary Oral Health Council (VOHC) poskytuje seznam produktů u kterých bylo prokázáno pomalejší tvoření plaku nebo zubního kamene. viz http://www.vohc.org/accepted_products.htm
Role krmiva na rozvoji onemocnění
Mokré, konzervované nebo měkké doma připravované krmivo je méně efektivní než krmivo suché. Avšak krmení suchým krmivem samo o sobě nemůže předcházet rozvoji onemocnění. Suché krmivo musí splňovat určité parametry, aby byla mechanická očista co nejlepší. Na prvním místě je to velikost částic. Tyto částice musí být dostatečně velké, aby u psa vyvolaly reflex kousání. Tvar musí být takový, aby došlo alespoň částečně k průniku zubu do částice a tím pádem k očištění zubu. Navíc se nesmí částice po skousnutí okamžitě rozdrtit na menší kousky. Důležitým faktorem je jak dlouhou dobu stráví pes žvýkáním. Rozlišujeme pomalé a rychlé žvýkače. Určitou roli hraje také frekvence podávání žvýkacích hraček a pamlsků. U těchto předmětů hraje roli jejich elasticita a odolnost. Svými vlastnostmi usnadňují mechanickou očistu celého povrchu zubu a výrazně prodlužují dobu žvýkání. Často se používají v kombinaci právě s chemickými látkami, jako solemi polyfosfátů nebo chlorhedinem. Soli polyfosfátů vyvazují vápenaté ionty slin a tím zabraňují tvorbě zubního kamene. Kromě solí polyfosfátů se používají ještě další látky, které zabraňují tvorbě zubního kamene popřípadě mají bakteriostatický efekt. Je to epigallocatechin gallát (catechin) patřící mezi polyfenoly. Jeho zdrojem je zelený čaj. Vyznačuje se antibakteriálním působením proti patogenům způsobujících zubní plak. Navíc je to silný antioxidant. Rozpustné soli zinku, jako například zinek askorbát či zinek glukonát se používají na kontrolu zubního plaku u koček. Jsou obsaženy v čistících gelech a výplaších. Rozmarýnový, levandulový a eukalyptový olej se využívají pro snížení zápachu z tlamy, navíc mají schopnost snižovat množství těkavých sirných sloučenin. Eukalyptový olej dokonce inhibuje růst patogenů.
Podávání tvrdých kostí na žvýkání moc nedoporučuji. Kosti se mohou tříštit na ostré části a poranit psa, navíc může kost uvíznout v krku, což je často indikace k chirurgické operaci. Nebo může dojít k vylomení zubů postižených patologickým procesem.
I přesto, že existuje řada chemických prostředků, které nám slibují odstranění kamene a plaku (jako například pasty, spreje, roztoky), nejdůležitější stále zůstává mechanická očista. Tyto prostředky můžeme používat v kombinaci s mechanickým čištěním plus ještě doplnit čištění nějakým žvýkacím pamlskem.
Syndrom GDV - Gastric dilatation and volvolus
Syndrom dilatace a volvolu žaludku je život ohrožující onemocnění psů. Je charakterizováno rychlým a abnormálním roztažením žaludku (dilatace) a často doprovázeno jeho otočením podél dlouhé osy (volvolus). K dilataci dochází v případech kdy se plyn, tekutina a sekrety hromadí v žaludku a nemůžou být vyloučeny dále do trávicího traktu z důvodu uzavření jak pylorického tak kardiálního svěrače. U postiženého psa dochází rychle ke zhoršení kondice. Je to způsobeno tím, že dilatovaný žaludek tlačí na hlavní břišní cévy, portální vénu a zadní dutou žílu. Tento tlak způsobí ztrátu krevního zásobení žaludku a dalších orgánů dutiny břišní. Navíc dochází ke snížení srdečního výdeje a rozvíjí se šok. Srdeční arytmie byly pozorovány u více než 40% psů s GDV. Tyto arytmie mohou způsobit smrt během týdne nebo měsíce po zotavení se ze syndromu GDV. Tímto syndromem jsou často postiženi psi s velkým hlubokým hrudníkem – Svatobernardský pes, Irský setr, Gordon setr, Královský pudl, Baset a Doga.
Klinické příznaky
Mezi hlavní klinické příznaky patří abdominální bolestivost a dispenze. Dále se objevuje kňučení, salivace a apatie. Zvíře může projevovat pokusy o zvracení, avšak neúspěšně. Jak proces progreduje, začíná se objevovat hypovolemický šok, který se projevuje nitkovitým pulsem, bledými sliznicemi, zrychlenou srdeční činností a unaveností.
Terapie
Jedinou možností terapie je operace – provede se dekomprese žaludku a jeho otočení. Jako preventivní opatření lze provést gastropexi – přišití stěny žaludku ke stěně dutiny břišní. Tento postup zabrání otočení žaludku kolem podélné osy.
Typický rentgenologický nález při GDV 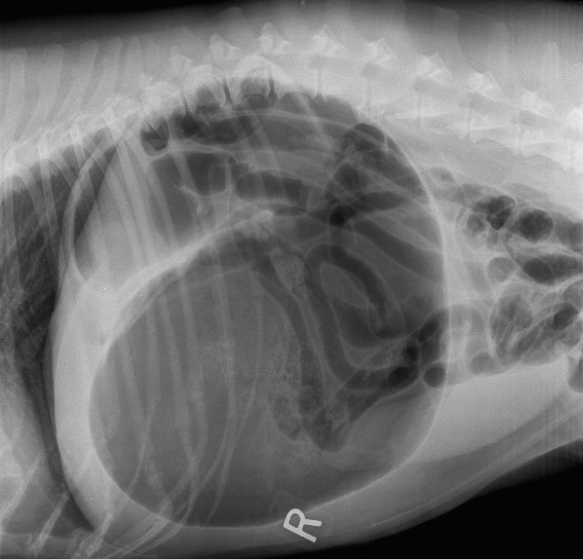
Zdroj: http://www.coolspringsah.com/our-blog/2014/6/18/seriously-scary-gdv
Etiologie
Na rozvoji tohoto faktoru se podílí řada faktorů. Mezi hlavní můžeme zařadit genetickou predispozici, vnitřní abnormality jako zvýšenou hladinu sérového gastrinu nebo porušenou motilitu střev. Gastrin je hormon produkován ve sliznici žaludku a střeva a stimuluje žaludeční sekreci a žaludeční a střevní motilitu. Faktory prostředí jako stres nebo nadměrná excitace zvířete před nebo po krmení, nebo příjmu většího množství vody může přispět k rozvoji GDV. Velký vliv na rozvoji onemocnění má i způsob krmení, typ krmení a jeho složení. Bylo zjištěno, že pokud rostoucí pes dostává krmivo pouze jednou denně, má větší a těžší žaludek, než pes, který dostává krmivo rozděleno do třech stejných dávek. Navíc takový pes krmnou dávku většinou rychle spořádá, přičemž může dojít také k polykání vzduchu. Krmení zbytky ze stolu, podávání pamlsků mezi krmením a přidávání konzervovaného krmiva do běžně krmeného krmiva zvyšují riziko vzniku GDV. Podávání krmiva do vyvýšené misky predisponovaným plemenům nezabrání jejich nafouknutí ba dokonce toto riziko zvyšuje.
Pooperativní péče spočívá v podávání malého množství vody několikrát denně první den po operaci. Pokud je voda tolerována a nedochází k zvracení, můžeme pomalu začít podávat krmivo 6 – 8krát denně. Nejvhodnější je dieta určená pro GIT onemocnění ve formě kaše. Nevyskytují – li se žádné komplikace, v průběhu následujících 3 – 4 dnů navyšujeme postupně krmnou dávku až se dostaneme na dávku před operací.
Prevence
Co se prevence týká, je třeba krmnou dávku rozdělit do několika malých dávek. Tím zamezíme nárazovému přeplnění žaludku psa. Krmení by mělo probíhat v době, kdy můžeme na psa alespoň 1-2 hodiny po nakrmení dohlédnout. Navíc při krmení musíme omezit stres zvířete. Pes by neměl dostat krmení alespoň 1 hodinu před a 3 hodiny po cvičení. Taky je třeba se vyvarovat vypití velkého objemu vody po cvičení nebo po nakrmení.
SIBO/ARD
SIBO- Small intestine bacterial overgrowth/ARD - antibiotic-responsive diarrhea
SIBO/ARD je onemocnění, které se objevuje, pokud dojde ke kvalitativním a kvantitativním změnám v populaci mikroorganismů proximální části tenkého střeva. U psa se jedná především o koliformní druhy bakterií, stafylokoky, enterokoky, Clostridia a Bacteroides. U koček se můžeme setkat s bakteriemi rodu Bacteroides, Pasterella, fusobakterie a eubakterie. Může se rozvinout také sekundárně v souvislosti s jinou patologií střeva (porucha střevní motility, dlouhodobé nebo nadměrné perorální podávání antibiotik nebo antacid, lymfocyto-plasmacitární enteritid, EPI) nebo idiopaticky. Motilita střeva zabraňuje bakteriálnímu přerůstání. Narušení střevní motility může být způsobeno obstrukcí střeva, neuropatií, chirurgickým zákrokem v dutině břišní, peritonitidou, pankreatitidou, urémií, hypokalemií a endotoxemií. Mezi nejčastější klinické příznaky patří občasný průjem doprovázený zvracením nebo nechutenstvím.
Diagnoza
Pro diagnostiku SIBO/ARD můžeme využít jak metody přímé tak nepřímé. Mezi přímé metody patří stanovení počtu bakterií v duodenální tekutině. Jako nepřímé metody diagnostiky můžeme využít stanovení folátů, kobaltaminu a žlučových kyselin ze séra. Hladina folátů bude zvýšená vlivem bakteriální produkce. Můžeme očekávat sníženou hladinu vitamínu B12 (bakterie zabraňují vazbě B12 na vnitřní faktor) a zvýšenou hladinu nekonjugovaných žlučových kyselin (dekonjugace kyselin bakteriálními enzymy).
Pathogen Overgrowth – Bakteriální přerůstání
Mikrobiální populace je velmi náchylná na změny. Její složení může být ovlivněno stresem, infekcí, podáváním antibiotik, nutričními faktory, poruchou motility a imunosupresí. Bakteriální přerůstání se může manifestovat jako samostatné onemocnění nebo jako složka SIBO/ARD nebo jiné forma poškození střeva.
Množící se patogenní baterie produkují toxiny, karcinogeny a hnilobné substance, které mohou přímo poškodit sliznici střeva, způsobit systémové onemocnění a v neposlední řadě inhibovat růst bakterií prospěšných. Nejčastějším střevním patogenem je Klostridium perfringens.
Běžné klinické příznaky zahrnují zvracení, průjem, ztrátu hmotnosti a v některých případech celkové postižení organismu vlivem produkovaných toxinů.
Inflammatory Bowel Disorders - Zánětlivé onemocnění střeva
IBD je multifaktoriální onemocnění. Zahrnuje rozdílnou skupinu poruch, které jsou obvykle klasifikovány podle typu převládajících zánětlivých buněk v mukóze střeva a podle postižené plochy.Nejčastěji bývají diagnostikovány zánětlivá onemocnění tlustého střeva (lymfocytoplasmatický, eosinofilní, histiocytární a granulomatozní zánět).
Chronické idiopatické zánětlivé onemocnění střeva (CILBD) je onemocnění související jednak se stresem a jednak s dalším faktorem, který ovlivňuje funkci střeva. Mezi tyto doprovodné faktory můžeme zařadit zánětlivé onemocnění, potravní intoleranci, bakteriální přerůstání, parazitární infekce a nádorová onemocnění.
Mezi hlavní klinické příznaky patří zvýšená frekvence vylučování, tenesmy a krvavý nebo hlenovitý průjem. Pokud je postiženo i tenké střevo můžeme pozorovat velké množství měkkého a objemného trusu popřípadě průjem s příměsí nestrávených tuků.
Léčba IBD a CILBD:
Při léčbě těchto dvou onemocnění se neobejdeme bez medikace. Cílem terapie je uklidnit zánětem podrážděnou sliznici a napomoci jejímu zahojení. Postiženým zvířatům podáváme protizánětlivé a imunosupresivní látky – kortikosteroidy (PREDNOSON nebo PREDNISOLON), SULFASALAZIN a v některých případech perorálně CYKLOSPORIN nebo METRONIDAZOL.
Tyto látky se vyznačují řadou nežádoucích účinků, proto je vhodné je podávat jen po nezbytně nutnou dobu.
Dietní management nám pomůže udržovat stav v remisi a předcházet možným relapsům onemocnění.
Dietní řešení GIT onemocnění
Dieta, která nám má pomoci zvládnout onemocnění GIT, by měla být vybírána tak, aby ochránila postižený úsek trávicího traktu. U akutně probíhajích onemocnění je vhodné poskytnout postiženému zvířeti krátkodobý půst (12 – 48 hodin) nebo výrazně omezit příjem potravy. Význam těchto opatření je v tom, že poskytneme střevu určitý čas na odpočinek. Déle probíhající onemocnění je třeba zvládnout vhodně zvolenou dietou.
Zdroj proteinů
EPI, SIBO/ARD a některé formy zánětlivého onemocnění střev můžou narušit trávení a vstřebávání proteinů. Může dojít k proteinové malnutrici. PLE (protein losing enteropathy) se objevuje, pokud dojde k rychlé a značné ztrátě proteinů. Pokud proteiny nejsou kompletně stráveny, dostávají se pasáži zažitiny do tlustého střeva, kde jsou metabolizovány bakteriemi kolonu – Bacterides spp a Clostridia spp. Tyto bakterie fermentují polypeptidy a aminokyseliny a začínají se intenzivně množit. Problém je, že zdravá, vyvážená mikroflora střeva je převážně tvořena bakteriemi sacharolytickými (štěpícími cukry).
Proto je důležité zajistit v dietě protein vysoké kvality, dobře stravitelný a nejlépe protein z jednoho zdroje (z důvodů možné hypersenzitivity). Nejlépe je vybrat ten zdroj proteinu, kterému zvíře nebylo dříve exponováno.
IBD může vézt k poruše trávení proteinů a poškodit sliznici střeva. Intaktní proteiny z potravy mají větší možnost dostat se přes poškozenou sliznici do lamina propria a stimulovat imunitní odpověď v aktivní periodě onemocnění. Nový zdroj proteinů, který je krmený během počáteční fáze onemocnění má jen krátkodobý přínos. Za 4 až 6 týdnů dietní terapie je třeba zdroj proteinu změnit a zvolit nějakou udržovací dietu. Bohužel v současné době nejsou žádné klinické ani experimentální důkazy o účinnosti tohoto postupu.
Zdroj cukrů
Při onemocnění GIT je vhodné dietou dodávat hlavně jednoduché cukry, které jsou snadno vstřebatelné a jsou pohotovým zdrojem energie. Jako vhodný zdroj cukrů můžeme doporučit bílou rýži, brambory, tapioka a kukuřice. Bramborový a tapiokový škrob je méně stravitelný než rýžový. Kukuřice může být kontraindikována u zvířat, která jsou na tuto složku krmiva alergická. Pšenice, oves a ječmen obsahují gluten. Gluten je zásobní protein, který s vodou tvoří lepek – mazlavou hmotu, která může způsobovat zhoršení střevní peristaltiky a snížené využívaní živin z krmné dávky. Zejména u plemene Irský setr se můžeme setkat s glutenovou enteropatií. je to vzácné vrozené onemocnění, projevující se intolerancí glutenu, částečnou atrofií klků, sníženou aktivitou enzymů a rozvojem malaabsorpčního syndromu.
Zdroj tuků
Při onemocnění GIT je potřeba podávat pacientům krmivo s redukovaným obsahem tuků (11 – 15% a méně celkového tuku). Příjem krmiva s vysokým obsahem tuku je kontraindikován u zvířat s EPI, postakutní pankreatitidou a lymfangiektázií. Nevstřebaný tuk je střevními bakteriemi metabolizován na hydoxy mastné kyseliny. Navíc tyto bakterie dekonjugují žlučové kyseliny. To všechno vede k sekrečnímu průjmu z distální části tenkého střeva a kolonu.
Zdroj vlákniny
Vláknina je fermentována střevními bakteriemi za vzniku významných konečných produktů, a to kyseliny octové, propionové a máselné (těkavé mastné kyseliny). Tyto kyseliny slouží jako energetický zdroj pro kolonocyty. Uhrazují více než 70% jejich energetických potřeb. Navíc přítomnost těchto kyselin v kolonu výrazně zvyšuje mitotický potenciál kolonocytů. Tím dochází k rychlejší obnově buněk. Průměrně se buňky obnovují po třech dnech. Také krevní tok v kolonu se v přítomnosti těchto kyselin zvyšuje. Substráty, které jsou nejméně fermentovatelné a jejichž fermentací vzniká nejméně těkavých mastných kyselin jsou například celuloza, burákové slupky, metylceluloza a další. Přesně opačný efekt mají tyto látky – guarová guma a pektin. Středně fermetovatelné jsou řepná pulpa, inulín, rýžové otruby a arabská guma. Vláknina zvyšuje peristaltickou aktivitu v distální části tenkého střeva, zatímco peristaltickou aktivitu kolonu pravděpodobně snižuje.
Celkově vláknina působí jako preventivní prostředek proti průjmu. Zvyšuje absorpci sodíku ve střevě, napomáhá zachovávat elektrolytovou a vodní rovnováhu a poskytuje živnou půdu pro růst prospěšných střevních bakterií zatímco inhibuje proliferaci těch patogenních.
Diety navržené na zvládnutí střevních potíží by měly obsahovat mezi 3 – 7% vlákniny, ale ne více než 10%. Rychlá fermentace a nadměrná tvorba těkavých mastných kyselin může způsobit řídkou stolici nebo průjem. Navíc vznikající plyn může zhoršit trávení a absorpci nutrietů krmiva.
Jako prebiotika označujeme nestravitelné komponenty krmiva, které příznivě působí na organismus. Mechanismus jejich účinku spočívá v tom, že podporují aktivitu a růst selektivních kmenů bakterií v tlustém střevě. Nejvíce prebiotik jsou po chemické stránce sacharidy s krátkým řetězcem např. inulín, galaktoologosacharidy, laktuloza, fruktooligosacharidy (FOS) a mananooligosacharidy (MOS). FOS a MOS jsou vysoce fermentovatelné prebiotika. MOS jsou obsaženy v kvasnicích. Působí tak, že zabraňují přichycení a kolonizaci patogenních bakterií na stěnu střevních buněk. FOS můžeme najít v ovoci, zelenině a obilovinách. Koncentrovaným zdrojem FOS jsou slupky ze sojových bobů, psyllium, čekanka a kořen cukrové řepy. V současné době je možno FOS vyrábět i komerčně fermentací substrátu plísní Aspergilus niger. FOS jsou selektivně metabolizovány bakteriemi rodu Bifidobakterium, Lactobacillus a Bacteroides. Tyto bakterie utilizují FOS přednostně před glukozou jako zdroj energie. Zatímco škodlivé bakterie jako Eubakterium, Salmonella a Clostridium FOS neutilizují vůbec nebo s menší efektivností. Prebiotika můžou pomoci zvládnout taková onemocnění jako SIBO/ARD a přerůstání střeva patogenními bakteriemi. Existují důkazy, že podávání prebiotik laktujícím fenám má vliv na množství imunoglobulinů v jejich mléce a zdraví sajících štěňat.
Jako probiotika označujeme prospěšné živé mikroorganismy osídlující trávicí trakt lidí i zvířat. Udržují vybalancovanou a zdravou střevní mikrobiální populaci. Působí jako prevence stresových, infekčních a s antibiotiky asociovaných průjmů, mají pozitivní vliv na GIT při SIBO a IBD. V současné době jsou probiotika dostupná v celé řadě forem – jako pasta, roztok, tablety atd. Je vhodné je při podávání zamíchat do předkládaného krmiva.
Směs probiotik a prebiotik se označuje jako symbiotikum.
Hepatobiliární onemocnění
Pro diagnostiku patologií jater a žlučových cest máme celou řadu metod. Mezi nejpoužívanější z nich můžeme zařadit analýzu krve a to jak hematologickou (PT, APTT, počet destiček) tak hlavně biochemickou (ALT, AST, ALP, GGT, žlučové kyseliny). Jako další metody můžeme použít analýzu moči, zobrazovací metody, a jaterní biopsii. Stimulační test žlučových kyselin je nejvíce specifický a senzitivní pro detekci hepatobiliárních onemocnění. Zvíře necháme před testem 12 hodin hladovět, poté odebereme krevní vzorek, podáme zvířeti krmivo a po dvou hodinách opět odebereme vzorek krve.
Léčba onemocnění jater
Pro léčbu onemocnění jater se využívá celá řada látek, které mají buď zabránit nenávratným změnám v podobě fibrotizace nebo látky, které mají povzbudit hepatocyty k množení. Glukokortikoidy se využívají při chronické hepatitidě. Využívá se jejich protizánětlivého a protifibrotického účinku. Glukokortikoidy jsou kontraindikovány v konečném stadiu cirhozy jater, při fibroze nezánětlivé etiologie a u pacientů s výraznou portální hypertenzí.
Při onemocnění způsobené bakteriální infekcí je nasnadě nasadit vhodná antibiotika. Látky s protifibrotickým účinkem se používají v konečném stadiu všech chronických jaterních onemocnění. Fibroza je nevratný proces poškození jater. Kolchicin, alkaloid z ocúnu jesenního, se používá pro svou schopnost zastavit a redukovat fibrotizaci jater (zastavuje množení fibrocytů a stimuluje kolagenázovou aktivitu). Jako vedlejší efekt se však dostavuje zvracení a průjem. Ursodeoxycholová kyselina (UDCA) je netoxická žlučová kyselina, která zvyšuje tok žlučových kyselin, rozřeďuje toxické žlučové kyseliny a moduluje imunitní systém. Je kontraindikována při obstrukci žlučovodů. Další látky používané při onemocnění jater jsou například Azathioprine, S-Adenosyl-L-Methionin (SAMe), Silymarin a dieta.
Glutathion (GSH) je jednou z hlavních defenzních látek v hepatocytech. Glutathion je tripeptid složený z kyseliny glutamové, cysteinu a glycinu. Chrání hepatocyty před intoxikací. Nedostatek glutathionu způsobuje oxidativní stres. SAMe je prekurzorem cysteinu, jedné ze základních aminokyselin v molekule glutathionu. Zvířatům se podává pouze po předchozím nakrmení.
Mezi hlavní účinky SAMe patří zvýšená hladina GSH v játrech, stimulace buněčné replikace a reparace, ochrana jaterních buněk před toxiny a buněčnou smrtí a podpora proteosyntézy. Navíc působí jako ochrana před volnými radikály, stabilizuje buněčnou membránu erytrocytů a u koček zlepšuje odtok žluči.
Sylimarin je složka extrahovaná z plodů rostliny Ostropestřec mariánský (Silybum marinum). Sylibin je jeho nejaktivnější součástí. Působí jako velmi silný lapač volných radikálů díky zvýšení intracelulární hladiny enzymu superoxiddismutázy (SOD).
Dieta při hepatobiliárních onemocněních
Energie
Druh a závažnost jaterního onemocnění má značný vliv na energetické nároky pacienta. Proto musí být dietní režim individuálně přizpůsoben nárokům jednotlivého pacienta. U pacientů s akutním zánětlivým onemocněním jater probíhají katabolické reakce více než u pacientů s cirhózou. Z toho důvodu jsou jejich nároky na energii vyšší.
Nemocná játra mají sníženou kapacitu pro skladování sacharidů a utilizaci proteinů. Z toho důvodu je vhodné podávat potravu častěji po malých dávkách. Zlepší se tím dostupnost sacharidů a rovnováha dusíku v těle.
Proteiny
Zvýšené dávky proteinů v krmné dávce k udržení pozitivní dusíkové bilance je třeba dodávat pacientům uzdravujícím se z ischemického poškození jater, akutní nekrózy jater a pacientům s chronickou hepatitidou.
Zvířatům s těžkým poškozením jater je třeba podávat dietu se sníženým množstvím proteinů. Minimální příjem proteinů pro zdravého psa je 1,25-1,75 g/kg.ž.hm., pro psa s chronickým selháním se toto množství pohybuje v rozmezí 2,0-2,2 g/kg.ž.hm. Toto množství vysoce kvalitního proteinu poskytne 70 – 110 kcal/(kg z d).
Restrikce proteinů u kočičích pacientů by neměla překročit minimální hodnoty doporučované pro kočky s chronickým ledvinným selháním. 3,3 – 3,5 g/kg.ž.hm. vysoce hodnotného proteinu v krmivu poskytne 70 – 80 kcal/(kg z d). Kočky nejsou schopné efektivně šetřit dusíkaté látky po restrikci.
Protein restrikční diety nejsou vhodné pro kočky s lipidózou jater a chronickou cholangiohepatitidou.
Vysoký obsah tuku v dietě a snížené množství proteinů jsou často nesprávně doporučovány u psů s vakuolární hepatopatií. Vakuolární hepatopatie je onemocnění způsobené zvýšeným ukládáním tuku v játrech bez schopnosti jeho transportu do periferií, kde může být oxidován. Toto onemocnění se vyskytuje u kníračů, šeltií, psů s pankreatitidou, IBD nebo cukrovkou.
Odhad proteinové a energetické malnutrice je založen na hodnocení změny tělesné hmotnosti, na hodnocení sérové koncentrace proteinů produkovaných játry ((albumin, a-globuliny, fibronektin, fibrinogen), na určení BSC a koncentrace kreatininu v seru.
Rovnováha mezi množstvím proteinu potřebného k dosažení pozitivní dusíkové bilance a množstvím proteinu, který vytváří vedlejší efekt – proteinová tolerance může být zvýšená přídanými medikamenty – orálně podávaná antibiotika – neomycin, metronidazol, laktuloza, neživočišný druh proteinu a dieta obohacená solubilní vlákninou.
Podtrhnuto sečteno, jaterní dieta by měla být hlavně chutná a měla by obsahovat protein vysoké biologické hodnoty. Dále by měla mít snížené množství sodíku a naopak zvýšené množství zinku a vitamínu K. Pokud nehrozí nebezpečí jaterní encephalopatie, není potřeba snižovat v krmné dávce množství proteinu.
Lipidoza jater u koček
Lipidoza jater je získané onemocnění způsobené zvýšenou akumulací triacyglycerolů v buňkách jater, při kterém nakonec dochází k porušení samotné funkce jater. Toto onemocnění se objevuje u koček ve středním věku, které mají nadváhu či jsou obézní. Onemocnění je vázáno na periodu částečného nebo úplného nechutenství (např. vyvolané stresem). Méně často se lipidoza vyskytuje jako sekundární onemocnění, například při IBD, cukrovce nebo onemocnění ledvin.
Etiologie
Cirkulující mastné kyseliny jsou transportovány do jater, kde jsou buď metabolizovány jako zdroj energie nebo přeměněny na triacyglyceroly. Tyto nově syntetizované TAG jsou z jater transportovány na bílkovinném nosiči (VLDL) do periferních tkání. Pokud dojde k překročení oxidační nebo transportní kapacity jater, rozvijí se lipidoza.
Kočky s lipidózou vykazují příznaky proteinové malnutrice (ztráta osvalení, anemie, hypoalbuminemie). Přidávání malého množství proteinů obezním kočkám během lačnění může sloužit jako prevence akumulace jaterních lipidů. Deficience argininu methioninu a L-karnitinu, sekundárně anorexie a ztráta proteinů usnadňují nástup FHL.
Klinické příznaky
K rozvoji onemocnění dochází po sedmi či více dnech nechutenství. Kočky najednou přestanou přijímat krmivo po náhlé změně životního stylu či prostředí nebo vlivem stresu – přestěhování do nového domu, příchod nového mazlíčka nebo změna krmiva. Později se objevuje deprese, ztráta hmotnosti, atrofie svalstva a žloutenka. Může se objevit i zvracení a průjem.
Laboratorní nálezy
Laboratorním vyšetřením krve se zjišťují zvýšené aktivity jaterních enzymů, bilirubinu a žlučových kyselin. Může také docházet ke zvýšení močoviny a amoniaku v krevní plazmě. Neregenerativní anemie je typická nepravidelnými tvary erytrocytů. Diagnoza by měla být potvrzena jaterní biopsií.
Léčba a dietární doporučení
Pro léčbu lipidozy je potřeba donutit pacienta přijímat krmivo a vodu. Násilné krmení může kvůli stresu při jeho provádění jen prohloubit nechutenství. Pokud není zbytí, je vhodné zavézt nasoesofageální sondu. Při prvním krmení za pomoci sondy je třeba kočce poskytnout čtvrtinu až polovinu její metabolizovatelné energie. Postupně se množství metabolizovatelné energie v krmné dávce zvyšuje. Krmivo bychom měli podávat minimálně 4krát denně. Jakmile se kočce vrátí apetit, můžeme snížit frekvenci krmení sondou a nechat kočku jíst samovolně. Je třeba minimalizovat veškerý stres, který může stav zvířete zhoršit.
Je třeba poskytovat krmivo, které obsahuje vysoké množství kvalitního proteinu a přiměřené množství tuku. Kočky, u kterých pozorujeme příznaky hepatoencephalopatií, krmíme nejdříve krmivem se sníženým obsahem proteinů. Jakmile odezní neurologické příznaky můžeme postupně dávky proteinů zvyšovat.
Většina koček potřebuje 3 až 6 týdnů intenzivní dietní terapie, poté se jejich laboratorní hodnoty obvykle vrátí do referenčního rozmezí.
Dieta předkládaná kočce s lipidózou by měla obsahovat ve vodě rozpustné vitamíny - zvláště thiamin, dále L-karnitin, taurin, vitamín E a vitamín K.
Pancreatitis - Zánět slinivky břišní
Akutní pankreatitida je většinou reversibilní krátce trvající onemocnění. Může mít extrémně rychlý nástup, ve vážných případech dochází k tkáňové nekróze a onemocnění může skončit potencionálně smrtí postiženého zvířete. Akutní forma onemocnění je nejčastěji diagnostikována u psů.
Chronická pankreatitida je trvalé, obvykle progresivní zánětlivé onemocnění. Je charakterizováno neustálým narušováním struktury a exokrinní (někdy i endokrinní) funkce žlázy. Povětšinou je diagnostikována u koček. Často probíhá jako subklinická nebo mírná forma onemocnění. Řada případů kvůli svému mírnému průběhu uniká diagnostice.
Mezi rizikové faktory, které jsou často zodpovědné za vznik pankreatitidy můžeme zahrnout nadváhu, obezitu, hyperlipidémii, krmení tučným krmivem, potravní intoleranci, přítomnost dalších onemocnění GIT (IBD, jaterní onemocnění), neoplastické procesy a expozice organismu účinkům léků (organofosfáty, L-asparagináza, azathioprin,…) nebo infekčních agens (Toxoplasma, FIP,…). Avšak řada případů je klasifikována jako idiopatická pankreatitida.
Klinické příznaky
Mezi hlavní klinické příznaky patří nechutenství, deprese, apatie, zvracení a ztráta hmotnosti. Dostavuje se také bolestivost břicha, dehydratace, ikterus a dušnost.
Management pankreatitidy
Zvířeti s pankreatitidou je nejdříve nutno zavést intravenozní kanylu a podat odpovídající množství tekutin. Pomocí infuzí se snažíme zkorigovat hypokalemii, elektrolytovou a acidobazickou rovnováhu. Na zmírnění bolesti je možno aplikovat opiáty.
Ve velmi akutních případech je možno zvážit krmení zvířete enterálně.
Dietní management pankreatitidy u psa
Při akutní pankreatitidě je vhodné v počátečních 48 hodinách nasadit psovi hladovku. Tím poskytneme odpočinek slinivce (snížení stimulace). Po této době je možno začít postupně předkládat krmivo, je –li tolerováno. Tuky a aminokyseliny jsou nutrienty, které zvyšují sekreci pankreatické šťávy. Proto z počátku zvolíme krmivo obsahující zvýšené množství sacharidů. Pak postupně zvyšujeme podíl tuků a proteinů v krmné dávce (z pravidla první a druhý týden po objevení se onemocnění).
Dietní management pankreatitidy u koček
Abdominální bolest a zvracení obvykle způsobují u koček nechutenství a následnou ztrátu hmotnosti. Dlouhodobé hladovění (více než 3 dny) sice zajistí uklidnění slinivky, ale prohlubuje ztrátu hmotnosti. Navíc hrozí riziko rozvoje jaterní lipidózy.
Pokud kočka netrpí zvracením, můžeme období nechutenství překonat pomocí gastrostomie nebo esofagostomie. Většinou jsou dobře tolerovány. Pro tento druh krmení můžeme použít komerční udržovací nebo intestinální dietu. Kočky jsou fyziologicky adaptovány na příjem krmiv s vysokým obsahem proteinů a tuků, tudíž jim toto krmení vyhovuje.
Exokrinní pankreatická insuficience
Slinivka břišní je žláza produkující jak pankreatickou šťávu (exokrinní funkce) tak hormony (endokrinní funkce). Nedostatečné množství trávicích enzymů se projevuje jako maldigesce a malabsorpční syndrom. U psů je častou příčinou EPI selektivní atrofie buněk acinů pankreatu. Byl zjištěn dědičný potenciál onemocnění. Nejvíce případů bylo diagnostikováno u Německých ovčáků a Kolií.
Méně často se EPI vyskytuje u koček jako následek chronické pankreatitidy. Genetický potenciál EPI u koček nebyl prokázán.
Hlavní enzymy jsou:
- Amyláza – enzym štěpící cukry (cukry a škroby v obilovinách, zelenině a ovoci)
- Lipáza – štěpí tuky
-Trypsin a proteázy štěpí bílkoviny na peptidy a aminokyseliny
Klinické příznaky:
Majitelé si často všimnou postupující ztráty hmotnosti i přes zachovalou chuť k jídlu. Zvířata častěji vylučují (někdy každou hodinu). Jejich výkaly jsou objemné, mastné a nažloutlé, připomínající kravské výkaly. Zvířata je často požírají. Postižení psi trpí nadýmáním a můžeme u nich slyšet kručení v břiše. V některých případech se může objevit vodnatý průjem nebo zvracení. Někteří psi však nevykazují žádné typické příznaky. SIBO/ARD je komplikací u více než 70% psů s EPI.
Dlouhodobý management EPI
Dlouhodobý management spočívá v podávání náhradních enzymů a v úpravě složení krmiva. Tato úprava podpoří trávení a vstřebávání živin. Podávané krmení musí být vysoce stravitelné. Z toho důvodu je lepší pokud je snížené množství vlákniny – podáváme krmivo bez obilovin. Navíc je vhodné krmivo obsahující hydrolyzovaný protein. Uvádí se, že stravitelnost by měla být vyšší než 90%. Předkládáme vyšší (1,5krát) množství krmiva, aby pacient nabral zpět ztracenou hmotnost. Krmivo má být energeticky bohatší, ale nemělo by obsahovat velké množství cholesterolu. Jsou vhodné mastné kyseliny se střední délkou řetězce. Pokud to není nezbytně nutné, nesnižujeme množství tuku v krmivu. U pacientů s EPI dochází často k deficinci vitamínů. Jedná se hlavně o kobaltamin, a vitamíny rozpustné v tucích. Sérová hladina vitaminu B12 by měla být pravidelně laboratorně zjišťována. Pacienti s fyziologickou hladinou B12 vitamínu v době stanovení diagnózy EPI obvykle v následujícím půl roce začnou být deficitní na tento vitamín. Pokud postiženému zvířeti nepodáváme B12, i přes zvládnutí EPI se rozvinou klinické příznaky nedostatku. Léčba spočívá v periodické injekční aplikaci kobaltaminu. Vyhneme se aplikaci multivitamínové směsi. Ta při aplikaci způsobuje bolest. Bylo zjištěno, že u některých pacientů dojde k rozvoji deficience vitamínů E a K i přes úspěšnou léčbu EPI pankreatickými enzymy. Přesný mechanismus tohoto jevu nebyl dostatečně vysvětlen.
Technika krmení spočívá v podávání malého množství krmiva několikrát denně (minimálně 3x). Navíc je třeba podávat antibiotika, za účelem zvládnutí SIBO.
Nalezení správné diety závisí na individualitě každého zvířete.
Enzymy
Enzymy podávané pro zvládnutí EPI se získávají extrakcí z prasečí slinivky. Enzymy v podobě prášku jsou účinnější než ve formě tablety.Počáteční dávky enzymů jsou docela vysoké. Obecně se používá 1 lžička enzymů v prášku na
9. Specifita nutričních požadavků psů a koček trpících onemocněním pohybového aparátu
U téměř každého čtvrtého psa, který navštívil veterináře, bylo diagnostikováno onemocnění pohybového systému. Onemocnění se vyskytuje u 22% psů mladších jednoho roku a více než 90% těchto případů je ovlivněno nutričními faktory. Adlibitní krmení krmivem bohatým na nutrienty a energii popřípadě podávání potravinových doplňků v období růstu jsou významným faktorem v rozvoji onemocnění.
Vývojové onemocnění kostí
Největší prevalence se objevuje u velkých a obřích plemen psů. Jejich nástup je obvykle spojován s obdobím rychlého růstu. Nejčastější onemocnění jsou: dysplazie kyčelního kloubu, hypertrofická osteodystrofie, některé formy osteochondrózy a panostitida.
Dysplazie kyčelního kloubu (DKK)
Toto onemocnění postihující kyčelní kloub je charakteristické nesouladem kloubních ploch mezi hlavicí femuru a acetabulem. Náchylná jsou plemena velkých a obřích psů. Dochází k remodelaci kloubu, acetabulum se stává mělčím, hlavice femuru se oplošťuje a počíná se vyvíjet osteoartitida (OA). DKK je multifaktoriální onemocnění. Z velké části se na jeho rozvoji podílí jak genetické faktory, tak faktory prostředí. Mezi faktory prostředí můžeme zahrnout druh krmení, rychlost růstu a nadměrnou zátěž. Růst mezi třetím a osmým měsícem věku je velmi rychlý a dochází k rychlému nárůstu tělesné hmotnosti. Proto je vhodné predisponovaná plemena psů krmit vhodným krmivem a vyvarovat se nadměrné zátěži. Majitelé psů si často všimnou ztíženého zvedání svého mazlíčka, zvláště po cvičení. Při prohmatávání kloubu pes vykazuje bolestivost. Po delší době začíná atrofovat svalovina zadní končetiny. Toto jsou hlavní klinické příznaky onemocnění.
Osteochondróza
Osteochondroza je onemocnění charakterizované poruchou enchondrální osifikace. Je to multifaktoriální onemocnění. Mezi rizikové faktory patří věk, plemeno, pohlaví, rychlý růst jedince, nadměrný váhový přírůstek a pravděpodobně nadbytek některých nutrientů (hlavně vápníku). Onemocněním jsou nejčastěji postihovány epifiseální chrupavky ramenního, kolenního, hlezenního a loketního kloubu. Kosti velkých plemen psů jsou relativně méně denzní než kosti malých plemen psů stejného stáří. Kosti velkých psů mají tenčí kortex, dřeňová dutina je prostornější a spongióza je také méně pevná. Dá se předpokládat, že kosti velkých plemen psů jsou během období růstu méně pevné než kosti malých plemen psů ve stejném období.
Mezi základní klinické příznaky patří bolestivost kloubů, kulhání a otok kolem postiženého kloubu. Klinika se většinou objevuje mezi pátým a devátým měsícem věku.
Osteochondritis dissecans
Toto onemocnění vzniká, když se oddělí část kloubní chrupavky od kosti a subchondrální kost je exponována synoviální tekutině. Oddělená část chrupavky se nachází volně v synovii a označuje se jako ,,joint mouse“. Jedinou možností nápravy je chirurgické vyjmutí.
Hypertrofická osteodystrofie
HO se vyskytuje u velkých a gigantických plemen psů. Je známo, že dochází k poruše krvení v oblasti kosti, kde se nachází růstová ploténka (to je oblast, díky níž kost roste do délky). Ploténka u zdravého jedince s postupem času osifikuje (kostnatí) až do stádia, kdy je tzv. ukončen růst dlouhých kostí. Tento proces je ale při hypertrofické osteodystrofii narušen. Poruchou krvení dochází k selhání nebo oddálení osifikace. Nezkostnatělý pás růstové ploténky se poté zvětšuje a v přilehlé kosti v důsledku toho vznikají zánětlivé změny, krváceniny, nekrózy, fraktury a rozsáhlé remodelující změny. Primárně jsou postiženi psi s rychlým růstem. Počáteční příznaky se začínají objevovat mezi třetím a šestým měsícem věku. Nejčastěji jsou zasaženy tyto kosti: distální část ulny, radius a tibia.
Klinické příznaky zahrnují akutní bolest, otok, kulhání, intermitentní horečku a příležitostně anorexii.
Panostitida
Generalizovaný zánět dlouhých kostí, zvláště humeru, radia, ulny, femuru a tibie. Ve více než polovině popsaných případů se postižení přesouvá z končetiny na končetinu, popřípadě postihuje všechny dlouhé kosti. Onemocnění je většinou diagnostikováno mezi pátým a dvanáctým měsícem života psa. Nástup je náhlý, od střední až po těžkou formu kulhání nastupující po předchozím traumatu nebo zranění. Může se objevit ztráta chuti k jídlu a přechodná horečka v akutní fázi onemocnění.

Nutriční faktory ovlivňující rozvoj onemocnění pohybového aparátu
Nadměrný příjem kalorií
Krmení psa adlibitně vysoce kvalitním krmivem může vézt k nadměrnému příjmu energie. Tento nadměrný příjem kalorií není kompatibilní s optimálním a zdravým vývojem pohybového aparátu. Dochází k abnormálnímu vývoji kostního aparátu – rozšíření kostochondrálního spojení a epifyzo-metafyzálního konce dlouhých kostí, hyperextenzi karpu a zhroucení matakarpofalangeálních a metatarsofalangeálních kloubů. Výskyt a závažnost dysplazie popřípadě osteoartitických změn je větší u štěňat, která přijímala více energie než je doporučováno.
Překrmování stimuluje rychlejší růst kostry. Dochází k rychlejší remodelaci kosti, jejimž výsledkem je kost, která má menší denzitu a menší schopnost nést tělesnou hmotnost. Navíc je kostní aparát psů mladších 12 měsíců více náchylný na působení fyzikálních a metabolických stresorů.
Předpokládá se, že abnormální vývoj kostí během období intenzivního růstu je způsoben rostoucí svalovou hmotou upínající se na kosti a zvyšující se tělesnou hmotností. Rychle rostoucí kost není tak pevná, aby odolala biomechanickému tlaku svalové hmoty.
Pro dosažení optimální rychlosti růstu, je třeba velká a gigantická plemena psů krmit kompletním a vybalancovaným krmivem.
Konečná výška psa je ovlivněna genetikou. Pokud poskytujeme psovi adekvátní množství vybalancované potravy, dosáhne konečné velikosti pomaleji, než pokud ho krmíme adlibitně. Nejlepší způsob jak kontrolovat správný růst psa, je přísně monitorovat tělesnou hmotnost a tělesnou kondici během období růstu. Energie krmiva nejvíce přispívá k rychlému růstu.
Tuk je největší zdroj energie. Proto je třeba při výběru krmiva sledovat jeho obsah. Ten by měl být v rozmezí 3,5 – 3,8 kcal/gram suchého krmiva. To odpovídá celkovému obsahu 12 – 16% tuku v krmivu, minimum je 8,5%. Co se obsahu proteinu týká, minimální množství je 22%, optimální množství je 26 – 28%. Toto množství proteinu poskytne cca 23 – 26% kalorií. Množství vápníku se doporučuje mezi 0,8 – 1,2%.
Energetické nároky rostoucích štěňat velkých plemen:
RER (kJ) = 293 x BW (kg)0.75
BW….body weight (hmotnost těla v kg)
do 4 měsíců věku (40 % konečné tělesné hmotnosti) = 3x RER
4-12 měsíců věku (80 % konečné tělesné hmotnosti) = 2-2.5x RER
12-18/24 měsíců věku (konečná tělesná hmotnost) = 1.8-2x RER
Nadměrný přísun vápníku a onemocnění kostí
Vápník je velmi důležitý makroprvek nezbytný pro správný vývoj kostí. Avšak jeho nadbytek může být velmi škodlivý. Minimální množství pro psy v reprodukci a rostoucí štěňata se doporučuje 0,8% sušiny, pro dospělé psy 0,5%. Množství vápníku by nemělo překročit 2,5% sušiny krmiva. Nadměrný příjem vápníku během růstu může vézt k rozvoji chronické hyperkalcemie a hypofosfatemie. Ta má za následek narušení zrání kosti, poškození její modelace a snížení počtu osteoklastů.
Zvýšená hladina vápníku působí na parafolikulární buňky štítné žlázy. Ty produkují zvýšené množství kalcitoninu. Jeho funkcí je snížit plazmatickou koncentraci vápníku a pomoci ho zabudovat do kosti. Výsledkem ovšem je snížená aktivita osteoklastů, která vede k narušení resorpce a sníženému vyzrávání kosti.
Mladí psi jsou neschopni regulovat absorpci a exkreci vápníku. Jejich homeostatické mechanismy udržující normální hladinu vápníku v krvi nejsou před 6 měsícem věku plně funkční. Proto je třeba, aby krmivo, kterým se krmí štěňata od odstavu obsahovalo adekvátní množství vápníku.
Vápník přijatý v potravě je absorbován přes sliznici tenkého střeva buď aktivním transportem (vitamín D) nebo pasivní difuzí. Pasivní difuze je přímo závislá na koncentraci vápníku v lumen střeva. Je to převládající cesta absorpce vápníku u novorozených a mladých zvířat (například odstavená štěňata absorbují až o 50% méně vápníku, bez ohledu na jeho množství v krmivu). S postupným dospíváním počíná u zvířat převládat aktivní transport a absorpce vápníku začíná být přísně kontrolována. Procento vápníku vstřebaného dospělci se různí (10 – 90%) a závisí na složení krmiva, obsahu vápníku v něm a fyziologickém stavu organismu.
Potřeba Ca
Množství vápníku v krmivu menší než 1% sušiny je pro štěňata velkých plemen přínosem. Optimální množství je 0,8% vápníku. Štěňata bychom neměli krmit krmivem pro dospělé psy (málo energie, moc vápníku).
Obecně, denní nároky na Ca a P u rostoucích psů jsou v závislosti na fázi růstu a plemeni → 200-500 mg/kg
→ 170-300 mg/kg
(vyšší nároky jsou v době výměny chrupu – 4.-7. měsíc věku)
Obsah Ca a P v krmivu pro rostoucí psy velkých a gigantických plemen
→ 0,8-1,2 % Ca (ostatní plenema až 1,8 %
+ poměr E = 0,5-1 g/1000 kJ)
→ 0,6-1,1 % P (ostatní plemena až 1,6 %
+ poměr E = 0,6 g/1000 kJ)
velká a gigantická plemena = Ca:P poměr 1,1-1,5:1
ostatní plemena Ca:P 1,1-1,8:1
Zdroje vápníku a fosforu
Zdroje těchto prvků můžeme rozdělit na organické (propionát vápenatý, laktát vápenatý) a anorganické (citrát vápenatý, uhličitan vápenatý, fosforečnan vápenatý).
Doma vyráběné diety
Kosti (5-17 % Ca), vaječné skořápky (34 % Ca), mléko, mléčné produkty, zelenina (využití vápníku je menší pokud jsou přítomny oxaláty nebo kyselina fytová)
Ca:P
kosti 2:1
mléko, jogurt 1.3:1
(tvrdý) sýr
tvaroh, tvarohové sýry 1,2-3:1
tavený sýr obsahuje velké množství fosforu
Osteoartritis – Osteoartitida
Jedná se o chronické progresivní onemocnění charakterizované destrukcí kloubní chrupavky, zesílením subchondrální kosti a novou formací osteofytů. Mezi rizikové faktory patří věk, plemeno (velké a gigantická plemena psů, Siamská, Himalájská a Perská kočka), vývojové onemocnění, trauma a obezita.
Kloub působí jako tlumič nárazů, chrání povrchy kostí a umožňuje flexibilitu a rozsah pohybu. Buňky lemující kloubní pouzdro produkují synoviální tekutinu. Synoviální tekutina lubrikuje kloubní povrchy, dodává živiny buňkám kloubní chrupavky a odvádí produkty metabolismu těchto buněk. Proteoglykany a kolagen jsou dvě základní komponenty, které přispívají ke zdraví kloubních chrupavek (viz dále).
Bez ohledu na primární příčinu kulhání nebo poruchu motility (vývojové, metabolické, genetické nebo traumatické) je konečným výsledkem těchto procesů v pokročilém věku osteoartritida – degenerativní onemocnění kloubů. Postihuje zvířata ve středním nebo pokročilém věku.
Klinické příznaky
Klinické příznaky OA jsou variabilní – od mírné bolestivosti bez změny hybnosti až po silnou bolest a funkční postižení. Objevuje se též kulhání, otok a horkost kloubu, bolest a ztuhlost po cvičení, snížený rozsah pohyblivosti a atrofie svalů.
Proteoglykany
Proteoglykan je velká molekula složená z více glykosaminoglykanových řetězců (GAG) obsahujících hyaluranan, chondroitin sulfát, dermatan sulfát, heparin sulfát a kreatin sulfát. Proteoglykany poskytují kloubní chrupavce vysokou hydrataci.
Kolagen
Kolagen se skládá z řetězců alfa
Se stárnutím zvířete dochází k fyziologickým změnám chrupavky zahrnující snížení obsahu kolagenu a GAG (zvláště chondroitin sulfátu) a snížení hydratace kloubu. Poranění nebo úraz můžou taktéž způsobit změny na klubu. Zdravé chondrocyty produkují proteoglykany, kolagen, fibronektin a další komponenty nezbytné k udržení správné funkce a zdraví kloubní chrupavky. Chondrocyty psů s OA vykazují určité abnormality.
Kulhání, nemoc a chronické onemocnění způsobí porušení homeostázy kloubní chrupavky. Ta začíná podléhat degenerativním procesům vlivem snížené syntézy extracelulární matrix. Nově syntetizované proteoglykany nejsou stejného složení jako proteoglykany v nepostiženém kloubu. Obsahují méně keratin sulfátu. Ke snížení obsahu kolagenu a proteoglykanů dochází též vlivem zvýšené aktivity metaloproteináz (MMP) a dalších proteináz v extracelulární matrix.
Fibronektin a další peptidy stimulují chondrocyty a synoviální buňky k uvolňování metabolitů kyseliny arachidonové (např. prostaglandin E2, leuktrien B4 a tromboxan). Tyto prozánětlivé substance zvyšují zánětlivou reakci v postiženém kloubním pouzdru.
Jakmile chondrocyty znekrotizují, zastavuje se syntéza extracelulární matrix a degenerativní proces kloubní chrupavky pokračuje.
Léčba
Chirurgická léčba
Chirurgická léčba je často doporučována v případech porušení hybnosti např. ruptura kraniálního křižového vazu nebo dysplazie kyčelního kloubu.
Medikamentózní léčba
Farmakologická terapie spočívá v podávání NSAID nebo kortikosteroidů. NSAID inhibují cyklooxygenázu – enzym produkující eikosanoidy (leukotrieny, tromboxany, prostaglandiny a prostacykliny). Jejich dlouhodobé podávání má však řadu vedlejších účinků. Různé NSAID blokují rozdílnou část kaskády kyseliny arachidonové. V současné době se používají látky ze skupiny kyseliny propionové (KARPROFEN) nebo ze skupiny oxikamů (MELOXIKAM). Nesteroidní antiflogistika podáváme vždy s potravou, abychom minimalizovali dráždění žaludku. Pokud se u pacienta objeví zvracení, inapetence nebo průjem, je nutno léčbu přerušit až do stabilizace stavu. Poté je možno v léčbě pokračovat, ale je třeba upravit dávkování. Jako prevenci nežádoucích účinků v podobě ulcerací žaludku je možno podávat MISOPROSTOL nebo RANITIDIN. Medikamentózní terapii je třeba doplnit nutriční podporou a snažit se udržet popřípadě dosáhnout optimální váhy zvířete.
Kortikoidy jsou potentní protizánětlivé látky. Lze je podávat celkově nebo lokálně – intraartikulárně. Perorální příjem je omezen jen na krátkou dobu a je třeba podávat co nejmenší dávku. Při intrartikulární aplikaci je nutno dodržovat zásady asepse. Aplikovat steroidy do kloubu nesmíme, pokud se chystáme provádět chirurgickou operaci na kloubu.
Nutriční podpora
Omega-3 mastné kyseliny
Eikosanoidy, které vznikají z omega-6-mastných kyselin (např. PGE2, leukotrien B4, Leukotrien C4 a tromboxan A2) působí jako lokální prozánětlivé mediátory. Zato eikosanoidy vznikající z omega-3-mastných kyselin, zvláště z kyseliny eikosapentaenové, působí mírně protizánětlivě. Zdrojem omega-3-mastných kyselin je například rybí nebo pupalkový olej.
Glykosaminoglykany
GAG jsou součástí proteoglykanů. Vytváří příčné vazby s kolagenem v chrupavce a ostatních pojivových tkáních. Mezi nejvýznamnější GAG patří chondroitin-4-sulfát, chondroitin-6-sulfát, keratin sulfát, dermatan sulfát a kyselina hyaruronová. Kyselina hyaluronová spolu s ostatními GAG poskytuje synoviální tekutině viskozitu a lubrikuje synoviální membrány kloubu.
Částečně synteticky vyrobené GAG jsou používány u psů a koní, kteří trpí neinfekčním degenerativním onemocnění kloubů.
Přípravky obsahující chondroitin-sulfát můžou pomoci snížit zánětlivou reakci a bolest. Navíc napomáhají vrátit synoviální tekutině její viskozitu a podporují reparaci kloubní chrupavky tím, že brzdí degenerativní procesy způsobené zvýšenou aktivitou proteolytických enzymů synoviální tekutiny.
Glukosaminy
Glukosaminoglukany jsou polysacharidové sloučeniny obsahující amino skupinu. Jsou tvořeny molekulami glukózy a aminokyseliny glutaminu. Vazbou GAG na proteiny vznikají proteoglykany - hlavní složka extracelulární matrix pojivových tkání. Jejich funkce je chránit a obnovovat pojivovou tkáň a chrupavku v kloubu postihnutém OA. Mají stimulující efekt na chondrocyty. Ty pak produkují více kolagenu a proteoglykanů.
Produkty obsahující GAG jsou běžně používány při degenerativních onemocnění kloubů, chrupavek a meziobratlových plotének (např. dysplazie kyčelního kloubu, spondylóza, OA, osteochondróza a řada nespecifických onemocnění kloubů způsobených zraněním).
Dlouhodobý benefit spočívá ve snížení diskomfortu, zánětlivých reakcí a zvýšení pohyblivosti nemocného zvířete.
Glukosamin sulfát a glukosamin hydrochlorid (sůl D-glukosaminu) mají pozitivní vliv na klouby. Řada studií je však zaměřena na zkoumání glukosaminu sulfátu, neboť tělo si D-glukosamin samo přeměňuje na Glukosamin sulfát.
|
Doporučená množství nutrientů v krmivu osteoartitických pacientů (vztaženo na suché krmivo) |
||
|
|
Pes |
Kočka |
|
Celkové omega – 3 MK |
3,5 – 4,0 % |
1,0 – 3,0 % |
|
0,4 – 1,1 % |
- |
|
|
- |
0,25 – 0,75 % |
|
|
poměr omega - 6 : omega - 3 |
1:1 |
2 – 4:1 |
|
≥ 300 mg/kg |
≥ 300 mg/kg |
|
|
Glukosamin hydrochlorid |
≤ 0,10 % |
- |
|
Chondroitinsulfát |
≤ 0,08 % |
- |
|
Antioxidanty |
|
|
|
≥ 100 mg/kg |
≥ 100 mg/kg |
|
|
≥ 400 IU/kg |
≥ 400 IU/kg |
|
|
0,5 – 1,3 mg/kg |
0,5 – 1,3 mg/kg |
|
|
Fosfor |
0,3 – 0,7 % |
0,5 – 0,7 % |
|
0,2 – 0,4 % |
0,2 – 0,4 % |
|
|
- |
0,05 – 0,1 % |
|
pozor u pacientů s onemocněním ledvin nebo srdce
prevence onemocnění dolních cest močových u starších koček
Kontrola hmotnosti a pohybová aktivita
Pokud má zvíře nadváhu nebo je dokonce obézní, degenerativní změny progredují a symptomy se stávají výraznější. Snížení tělesné hmotnosti může oddálit nástup osteoartitických změn, snížit bolestivost a zvýšit motilitu pacientů. Pokyny pro snížení a udržení ideální tělesné hmotnosti psů jsou stejné jako u psů, kteří netrpí OA. Snížení hmotnosti navíc sníží množství užívaných protizánětlivých léků.
Co se pohybové aktivity týče, majitel by neměl svého psa nadměrně přetěžovat. Jako nejvhodnější druh pohybu se jeví plavání. Z počátku je vhodné ponechat psa plavat 1 – 3 minuty 3 nebo více dní v týdnu. Po získání určité zdatnosti je možno nechat psa plavat déle. Dále je možno doporučit procházky se psem na vodítku popřípadě pohyb na běžeckém pásu. Psi žijící sedavým způsobem života by měli být zatěžováni postupně. Doporučují se krátké procházky na 5 – 15 minut každý den. Omezit nebo vyhnout bychom se měli všem aktivitám, které vedou k nadměrnému zatížení klubů postižených OA (klus, běh, skákání).

10. Nežádoucí reakce na krmivo
Nežádoucí reakce na krmivo
Hypersenzitivita je stav, organismus neadekvátně reaguje na antigeny imunologickou reakcí, jejímž výsledkem je klinická manifestace. Po celý život konzumují psi a kočky krmivo obsahující různé druhy mas a obilovin, které mohou být potencionální alergeny. Hypersenzitivita na krmivo se vyskytuje u psů různého stáří (od 4 měsíců do 11 let). Jedná se o celoroční alergické onemocnění, diagnostikované u 33% psů do jednoho roku stáří, u 51% psů ve věku jednoho až tří let a u 16% psů ve věku 4-16 let. Etiologie onemocnění není přesně známá. Pravděpodobně se uplatňuje alergická reakce 1.,
Příklady nežádoucích reakcí na krmivo
Potravní hypersenzitivita – imunitně podmíněná reakce organismu na nějakou složku potravy.
Potravní nesnášenlivost – neadekvátní reakce na krmivo, která nemá imunitní mechanismus. Mezi potravní nesnášenlivost můžeme zařadit neadekvátní metabolické reakce (např. intolerance laktózy), reakce na aditiva v krmivech (glutamát, kyselina sorbová), alimentární intoxikace (produkce toxinů plísněmi a bakteriemi, dusičnany, dusičnany, histamin, metylxantin).
Příznaky potravní intolerance se projevují dvěma způsoby – gastrointestinální manifestace nebo kutánní manifestace.
GIT projevy mohou být diarrhoea a/nebo zvracení, hemoragická gastroenteritida, malabsorpce, zvýšená produkce hlenu v tlustém střevě, hubnutí a zhoršení tělesné kondice.
Mezi hlavní dermatologické příznaky patří pruritus, tvorba papul a pustul a recidivující otitis externa. K sekundárním komplikacím můžeme připojit exkoriace, alopecie, sekundární pyodermie, seborea, hyperpigmentace a lichenifikace. Pruritus se často vyskytuje na predilekčních místech (ušní boltce, tlapky, tříselná krajina, podpaží).
Asi 10 – 15% psů trpí kromě kožní formy onemocnění i GIT formou.
|
Nejčastější alergeny v potravě |
||
|
zdroj proteinů |
zdroj sacharidů |
doplňkové látky |
|
kravské mléko, vejce, hovězí maso, sója, koňské maso, vepřové maso, kuřecí maso |
pšenice, kukuřice rýže |
kvasnice, konzervační látky – BHT, Glutamát sodný |
Diagnostika
Potravní alergii je nutno odlišit od jiných typů alergie, bakteriálních, parazitárních a plísňových infekcí, endokrinních poruch a deficientů ve výživě. Je – li u pacienta po vyloučení diferenciálních diagnóz podezření a potravní alergii přistoupíme k dalšímu diagnostickému kroku a tím je eliminační dieta. Eliminační dieta je speciální druh krmení, pomocí kterého zjistíme alergizující složku potravy.
Průmyslově vyráběné eliminační diety – diety s hydrolyzovaným proteinem
Podstatou těchto diet je hydrolyzovaná bílkovina. Ta by měla být rozložena na komponenty menší než 18 000 Da (většina výrobců uvádí míru rozložení bílkovin mezi 3 000 – 12 000 Da). Takto zpracované proteiny nejsou zachytávány imunitním systémem a nevyvolávají potravní hypersenzitivitu.
Doma připravovaná dieta – metoda použití neobvyklého proteinu
U některých zvířat se může stát, že nerada přijímají granulovaná krmiva nebo je majitel finančně limitován. V tomto případě musíme zvolit diagnostický postup za pomoci doma připravované diety. Optimálními komponentami pro přípravu diety je z bílkovinných složek vhodné králičí, jehněčí, dančí nebo rybí maso. Každopádně bychom měli mít na paměti, že zvíře by se nemělo se stejným zdrojem proteinů setkat alespoň 6 týdnů před začátkem testu. Jako zdroj sacharidů je vhodné použít brambory, kukuřičné těstoviny, tapioku nebo pohanku.. Takto připravenou krmnou dávku je vhodné obohatit o vitamíny a minerály. Volíme spíše formu roztoku, jelikož tablety mohou mít v sobě jako nosič nějakou z alergizujících látek.
Příklady doma připravovaných diet:
|
475 g dančího msasa 500 g neloupaných brambor 25 g oleje z vinných semen tato dieta obsahuje zhruba 1140 kcal/kg |
|
500 g kachny nebo makrely (s kůže) 480 g tapioky nebo rýže 10 g oleje z vinných semen tato dieta obsahuje zhruba 1325 kcal/kg |
Při provádění krmného testu je velmi třeba dodržovat uvedená časová období. Nevýhodou tohoto testu je jeho časová náročnost. Objevení se klinických příznaků při použití provokačního testu je individuální (od několika hodin po dobu 14 dní). K provedené testu nelze použít diety označené jako sensitive, hypoalergenní, sensible, lamb+rice atd.
Časové schéma eliminačního testu
|
Bez odezvy na testaci |
provokační testace |
|
|
|
|
Nejedná se o hypersenzitivitu |
|
|
|
|
|
eliminační dieta |
eliminační dieta |
eliminační dieta |
eliminační dieta |
eliminační dieta |
|
|
přidán 1 alergen |
|
přidán 1 alergen |
|
|
6 týdnů |
3 týdny |
2 týdny |
3 týdny |
2 týdny
|